Apakah perbezaan antara sel voltan dan sel elektrolisis
Perbezaan utama antara sel voltan dan sel elektrolisis adalah bahawa sel voltan menggunakan tenaga yang dilepaskan semasa tindak balas redoks spontan untuk menjana elektrik, sedangkan sel elektrolisis menggunakan tenaga elektrik dari sumber luaran untuk memaksa reaksi berlaku berlaku.
Sel voltan atau sel galvanik dan sel elektrolisis adalah dua istilah penting dalam elektrokimia. Elektrokimia dapat digambarkan sebagai kajian hubungan antara elektrik dan tindak balas kimia. Terdapat dua jenis sel elektrokimia; mereka adalah sel voltan dan sel elektrolisis.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu sel voltan
3. Apakah sel elektrolitik
4. Sel voltan vs sel elektrolisis dalam bentuk jadual
5. Ringkasan -Sel voltan vs sel elektrolisis
Apa itu sel voltan?
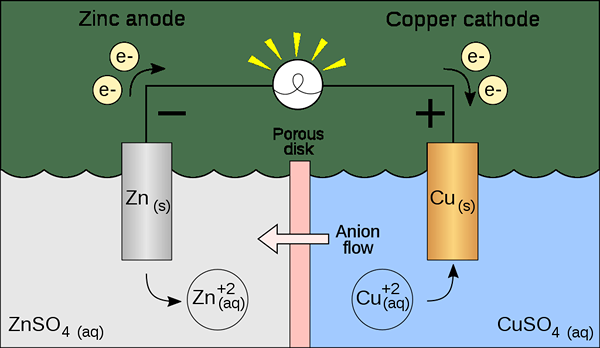
Sel voltan adalah jenis sel elektrokimia yang menggunakan tindak balas redoks spontan untuk menjana tenaga elektrik. Ia juga dikenali sebagai sel galvanik. Sel mengandungi dua sel separuh yang boleh menjadi komposisi yang sama atau komposisi yang berbeza. Setiap sel separuh mengandungi elektrod dan elektrolit. Elektrod harus direndam dalam larutan elektrolisis. Kadang -kadang, elektrolit ini benar -benar terpisah, tetapi masa lain, mereka dipisahkan hanya dengan halangan berliang. Apabila elektrolit dipisahkan sepenuhnya, kita perlu menggunakan jambatan garam untuk mengekalkan pergerakan ion antara kedua -dua elektrolit.

Rajah 01: Sel voltan
Dalam menyediakan sel ini, kita perlu mempertimbangkan sama ada elektrod dan elektrolit adalah spontan atau tidak. Kita dapat menemuinya secara teoritis dengan mengira potensi elektrod setiap sel separuh. Walau bagaimanapun, satu sel separuh harus menunjukkan pengoksidaan, sedangkan sel separuh lagi harus menunjukkan reaksi pengurangan. Pengoksidaan berlaku pada anod, sedangkan pengurangan berlaku di katod. Oleh kerana sel galvanik (voltan) menggunakan tenaga yang dikeluarkan semasa tindak balas redoks spontan untuk menjana elektrik, sel galvanik penting sebagai sumber tenaga elektrik. Mereka menghasilkan arus langsung.
Apakah sel elektrolitik?
Sel elektrolitik adalah peranti di mana tenaga elektrik ditukar menjadi tenaga kimia atau sebaliknya. Jenis sel ini biasanya mengandungi dua konduktor logam atau elektronik yang dipegang selain antara satu sama lain dan bersentuhan dengan elektrolit yang biasanya dibubarkan atau disatu dalam sebatian ionik.
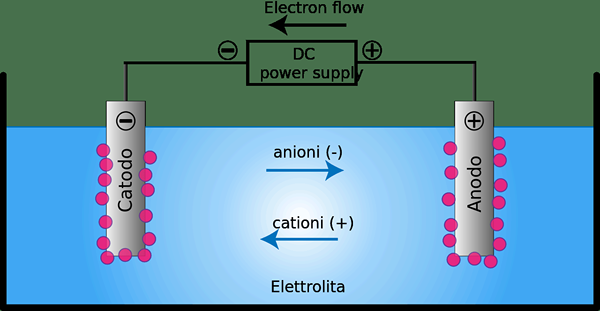
Rajah 02: Sel elektrolisis
Kita boleh menggunakan sel elektrolitik sebagai sel elektrokimia yang digunakan untuk membuat elektrolisis berlaku dalam sebatian tertentu. Untuk e.g. Menundukkan air ke elektrolisis boleh membentuk oksigen gas dan hidrogen gas. Peranti ini menggunakan arus elektrik untuk memacu reaksi redoks termodinamik. Selain itu, pengoksidaan berlaku di anod, sementara pengurangan berlaku di katod.
Apakah perbezaan antara sel voltan dan sel elektrolisis?
Istilah sel voltan (sel galvanik) dan sel elektrolitik sangat penting dalam pengeluaran elektrik. Perbezaan utama antara sel voltan dan sel elektrolitik ialah sel voltan menggunakan tenaga yang dikeluarkan semasa tindak balas redoks spontan untuk menjana elektrik, sedangkan sel elektrolisis menggunakan tenaga elektrik dari sumber luaran untuk memaksa reaksi berlaku. Apabila mempertimbangkan pelepasan tenaga mereka, sel voltan memperoleh tenaga dari tindak balas redoks spontan, sedangkan sel-sel elektrolitik melibatkan tindak balas bukan spontan, dan oleh itu, memerlukan sumber elektron luaran seperti bateri DC sumber kuasa AC.
Jadual berikut meringkaskan perbezaan antara sel voltan dan sel elektrolitik.
Ringkasan -Sel voltan vs sel elektrolisis
Sel voltan dan sel elektrolisis adalah dua istilah penting dalam elektrokimia. Perbezaan utama antara sel voltan dan sel elektrolitik ialah sel voltan menggunakan tenaga yang dikeluarkan semasa tindak balas redoks spontan untuk menjana elektrik, sedangkan sel elektrolisis menggunakan tenaga elektrik dari sumber luaran untuk memaksa reaksi berlaku.
Rujukan:
1. "Elektrokimia (artikel)." Akademi Khan.
Ihsan gambar:
1. "Sel Galvanik Tanpa Aliran Kation" oleh Asal: Vektor Ohiostandard: Anticompositenumber - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia
2. "Caj sel elektrolitik" oleh Rodez2 - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia


