Apakah perbezaan antara momen polarizability dan dipole
The Perbezaan utama antara momen polarizability dan dipole adalah bahawa polarizability adalah ukuran bagaimana dengan mudah awan elektron diputarbelitkan oleh medan elektrik, sedangkan momen dipole adalah pemisahan caj positif dan negatif dalam sistem.
Momen polarizability dan dipole adalah dua istilah penting dalam kimia yang diterangkan berhubung dengan atom, molekul, dan awan elektron mereka.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Polarizability
3. Apa momen dipole
4. Polarizability vs dipole momen dalam bentuk jadual
5. Ringkasan -Polarizability vs Dipole Moment
Apa itu Polarizability?
Polarizability boleh digambarkan sebagai kecenderungan perkara untuk memperoleh momen dipol elektrik berkadar dengan medan yang digunakan apabila medan elektrik digunakan. Fenomena ini adalah harta benda dari semua perkara apabila kita menganggap perkara itu dibina dari zarah -zarah asas yang mempunyai caj elektrik dengan cara proton dan elektron.
Di hadapan medan elektrik, elektron yang dikenakan secara negatif dan nukleus atom yang dikenakan secara positif menjalani kesan daya bertentangan dan pemisahan caj. Polarizability bertanggungjawab untuk pemalar dielektrik bahan dan indeks biasan apabila frekuensi tinggi dianggap.
Selain itu, kebolehkerjaan atom atau molekul adalah nisbah momen dipole yang disebabkan dan medan elektrik tempatan. Apabila pepejal kristal dipertimbangkan, kita dapat mengenal pasti momen dipole per unit sel. Selain itu, medan elektrik tempatan dapat dilihat oleh molekul yang umumnya berbeza dari medan elektrik makroskopik kita dapat mengukur secara luaran.
Begitu juga, kebolehkerjaan magnet merujuk kepada kecenderungan momen dipole magnet untuk muncul dalam perkadaran dengan medan magnet luaran. Polarizabiliti elektrik dan polarizabiliti magnet Tentukan tindak balas dinamik sistem terikat ke medan luaran dan memberikan gambaran tentang struktur dalaman molekul.
Apa momen dipole?
Momen dipole dapat digambarkan sebagai pemisahan caj elektrik. Pemisahan caj mungkin berlaku di antara dua ion dalam ikatan ionik atau dua atom dalam ikatan kimia kovalen. Momen dipole timbul kerana perbezaan antara nilai elektronegativiti atom yang berbeza yang membentuk ikatan kimia. Semakin besar perbezaan antara nilai elektronegativiti, semakin besar momen dipole. Momen dipol mengukur polariti molekul. Momen dipole molekul dikira menggunakan persamaan berikut.
μ = σq.r
μ adalah momen dipole, q adalah magnitud caj, dan r adalah kedudukan caj. Di sini, μ dan r adalah vektor, yang merupakan kuantiti yang mempunyai arah serta magnitud.

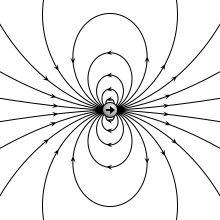
Rajah 01: Medan elektrik dipol elektrik
Tetapi kadang -kadang, istilah dipole momen digunakan untuk menamakan ukuran polaritas magnet sistem caj. Momen dipole magnet menentukan tork yang pengalaman magnet dalam medan magnet luaran. (Tork = momen; daya putaran).
Apakah perbezaan antara momen polarizability dan dipole?
Momen polarizability dan dipole adalah dua istilah penting. Perbezaan utama antara polarizabiliti dan momen dipol adalah bahawa polarizability adalah ukuran bagaimana dengan mudah awan elektron diputarbelitkan oleh medan elektrik, sedangkan momen dipole adalah pemisahan caj positif dan negatif dalam sistem.
Jadual berikut meringkaskan perbezaan antara polarizability dan momen dipole.
Ringkasan -Polarizability vs Dipole Moment
Polarizability adalah kecenderungan perkara untuk memperoleh momen dipol elektrik berkadar dengan medan yang digunakan apabila medan elektrik digunakan, sementara momen dipole adalah pemisahan caj elektrik. Perbezaan utama antara polarizabiliti dan momen dipol adalah bahawa polarizability adalah ukuran bagaimana dengan mudah awan elektron diputarbelitkan oleh medan elektrik, sedangkan momen dipole adalah pemisahan caj positif dan negatif dalam sistem.
Rujukan:
1. "Polarizability." Kimia Libreetexts, Libretexts, 4 Mei 2022.
Ihsan gambar:
1. "VFPT Dipole Animation Electric" oleh Geek3 - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia


