Perbezaan antara keasidan dan asas

Perbezaan utama - Keasidan vs asas
Keasidan dan asas sebatian adalah petunjuk pH. Keasidan medium disebabkan oleh sebatian berasid, yang boleh melepaskan ion hidrogen (h+), mengakibatkan pH yang rendah dalam medium itu. Asas medium disebabkan oleh sebatian asas, yang boleh melepaskan ion hidroksida (oh-), menghasilkan pH yang tinggi dalam medium itu. Perbezaan utama antara keasidan dan asas ialah keasidan menyebabkan pH yang rendah manakala asasnya menyebabkan pH yang tinggi dalam medium berair.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu keasidan
3. Apa itu asas
4. Perbandingan sampingan - Keasidan vs asas dalam bentuk jadual
5. Ringkasan
Apa itu keasidan?
Keasidan adalah tahap asid dalam bahan. Kepekatan ion hidrogen (h+) adalah parameter utama yang digunakan untuk mengenal pasti keasidan. Kepekatan ion hidrogen dinyatakan sebagai nilai pH. pH ialah logaritma negatif kepekatan ion hidrogen. Oleh itu, lebih tinggi kepekatan ion hidrogen, menurunkan pH. Nilai pH yang rendah menunjukkan keasidan yang lebih tinggi.
Menurut keasidan bahan, terdapat dua jenis asid sebagai asid kuat dan asid lemah. Asid kuat menyebabkan tahap keasidan yang lebih tinggi dalam medium berair manakala asid lemah mengakibatkan keasidan yang rendah. Asid yang kuat dapat memisahkan sepenuhnya ion, melepaskan semua ion hidrogen yang mungkin (h+). Sebaliknya, asid lemah sebahagiannya memisahkan, melepaskan hanya beberapa ion hidrogen. Asid juga boleh dikategorikan sebagai asid monoprotik dan asid poliprotik; Asid monoprotik melepaskan satu ion hidrogen setiap molekul manakala asid poliprotik melepaskan lebih banyak ion hidrogen setiap molekul.
Keasidan asid ditentukan oleh PKA asid. PKA adalah logaritma negatif KA. KA adalah pemalar pemisahan asid penyelesaian. Ia adalah pengukuran kuantitatif kekuatan asid dalam larutan (atau keasidan). Menurunkan PKA, semakin kuat asid. Lebih tinggi PKA, semakin lemah asid.

Rajah 01: Jus lemon mempunyai keasidan yang tinggi
Trend berkala keasidan elemen kimia pada dasarnya bergantung pada nilai elektronegativiti mereka.Elektronegativiti elemen kimia meningkat dari kiri ke kanan dalam tempoh. Sekiranya elektronegativiti atom lebih tinggi, ia dapat menstabilkan atom negatif di atasnya dengan mudah kerana ia mempunyai pertalian yang lebih tinggi untuk elektron. Oleh itu, ion hidrogen yang dikaitkan dengan atom elektronegatif yang tinggi mudah dibebaskan daripada atom elektronegatif yang rendah, mengakibatkan keasidan yang lebih tinggi. Apabila turun kumpulan dalam jadual berkala, keasidan meningkat. Ini kerana saiz atom meningkatkan kumpulan. Atom besar boleh menstabilkan caj negatif pada mereka (dengan pengagihan caj); oleh itu ion hidrogen yang dikaitkan dengan atom besar dengan mudah boleh dikeluarkan.
Apa itu asas?
Asas bahan adalah bilangan atom hidrogen yang boleh digantikan oleh asas dalam asid tertentu. Dengan kata lain, asas sebatian adalah bilangan ion hidrogen yang boleh bertindak balas sepenuhnya dengan ion hidroksida yang dikeluarkan oleh asas.
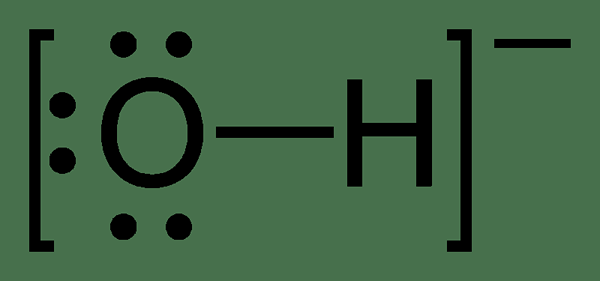
Rajah 02: Struktur kimia ion hidroksida
Faktor yang boleh menjejaskan asas sebatian disenaraikan di bawah.
- Elektronegativiti
- Jejari atom
- Caj rasmi
Elektronegativiti atom merujuk kepada pertaliannya untuk elektron. Atom yang mempunyai elektronegativiti yang tinggi dapat menarik elektron jika dibandingkan dengan atom elektronegatif yang rendah. Lebih tinggi elektronegativiti, menurunkan asasnya. Untuk melepaskan ion hidroksida, elektron ikatan antara atom oksigen dan selebihnya molekul harus sepenuhnya tertarik oleh atom oksigen (atom oksigen dalam kumpulan hidroksida harus lebih elektronegatif daripada atom lain yang terikat kepada). Cth: Sekiranya asas ROH tinggi, elektronegativiti R lebih kecil daripada atom oksigen.

Rajah 03: Sabun adalah asas lemah yang dibentuk oleh tindak balas asid lemak dengan natrium hidroksida atau kalium hidroksida.
Radius atom adalah faktor lain yang mempengaruhi asas sebatian. Sekiranya jejari atom kecil, ketumpatan elektron atom itu tinggi. Oleh itu, ion hidroksida dengan mudah boleh dikeluarkan. Maka asas sebatian itu agak tinggi.
Caj rasmi secara amnya sama ada caj positif atau caj negatif. Caj rasmi positif menunjukkan ketumpatan elektron yang kurang. Oleh itu, elektron bon tidak dapat ditarik sepenuhnya oleh ion hidroksida. Kemudian ia tidak dapat dikeluarkan dengan mudah (ion hidroksida), menunjukkan asas yang lebih rendah. Sebaliknya, caj formal negatif menyebabkan asas yang lebih tinggi.
Apakah perbezaan antara keasidan dan asas?
Keasidan vs asas | |
| Keasidan adalah tahap asid dalam bahan. | Asas merujuk kepada keadaan menjadi asas, yang boleh melepaskan ion hidroksida (OH-). |
| Ph | |
| Keasidan menyebabkan pH yang rendah dalam medium berair. | Asas menyebabkan pH yang tinggi dalam medium berair. |
| Ion | |
| Keasidan menunjukkan kepekatan ion hidrogen yang tinggi dalam medium. | Asas menunjukkan kepekatan ion hidroksida yang tinggi dalam medium. |
| Trend berkala | |
| Keasidan meningkat dari kiri ke kanan tempoh dan ke bawah kumpulan. | Asasnya berkurangan dari kiri ke kanan tempoh dan ke bawah kumpulan. |
| Kesan elektronegativiti | |
| Keasidan adalah tinggi jika elektronegativiti (atom yang mana atom hidrogen terikat) adalah tinggi. | Asasnya tinggi jika elektronegativiti (atom yang mana atom oksigen ion hidroksida terikat) adalah rendah. |
Ringkasan - Keasidan vs asas
Keasidan dan asas adalah dua istilah asas yang digunakan dalam kimia. Keasidan disebabkan oleh sebatian berasid. Asas disebabkan oleh sebatian asas. Perbezaan utama antara keasidan dan asas adalah bahawa keasidan menyebabkan pH yang rendah manakala asasnya menyebabkan pH yang tinggi dalam medium berair.
Rujukan:
1. "7.3: Kesan struktur keasidan dan asas."Kimia Libretexts, Libretexts, 7 Sept. 2016, boleh didapati di sini.
2. "Trend jadual berkala."Rangkaian Doktor Pelajar, boleh didapati di sini.
Ihsan gambar:
1. "Lemon-Edit1" oleh André Karwath aka aka-Kerja Sendiri (CC BY-SA 2.5) Melalui Wikimedia Commons
2. "Hydroxide-Lone-Fairs-2d" (Domain Awam) melalui Commons Wikimedia
3. "589824" (CC0) melalui Pixabay