Apakah perbezaan antara etanol dan methoxymethane

The Perbezaan utama antara etanol dan methoxymethane adakah etanol berlaku sebagai cecair tidak berwarna yang sangat tidak menentu pada suhu bilik, sedangkan methoxymethane berlaku sebagai gas tidak berwarna pada suhu bilik.
Etanol dan methoxymethane mempunyai formula kimia yang sama tetapi struktur kimia yang berbeza, yang menentukan sifat kimia yang berbeza dari sebatian ini. Etanol atau etil alkohol adalah sebatian organik yang mempunyai formula kimia c2H5Oh. Methoxymethane adalah sebatian eter yang mempunyai formula kimia c2H6O.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu etanol
3. Apa itu methoxymethane
4. Etanol vs methoxymethane dalam bentuk jadual
5. Ringkasan -etanol vs methoxymethane
Apa itu etanol?
Etanol atau etil alkohol adalah sebatian organik yang mempunyai formula kimia c2H5Oh. Ia berguna sebagai bahan bakar. Walau bagaimanapun, ia adalah sebatian yang sama yang kita dapati dalam minuman beralkohol. Selalunya, bahan api ini digunakan sebagai bahan api motor, sebagai bahan tambahan biofuel untuk petrol.

Rajah 01: sebotol etanol
Adalah mungkin untuk menghasilkan etanol melalui cara biologi atau kimia. Langkah -langkah utama menghasilkan etanol melalui cara biologi termasuk penapaian, penyulingan, dan dehidrasi. Semasa penapaian, mikrob bertindak ke atas gula untuk mengubahnya menjadi etanol. Langkah penyulingan melibatkan penyingkiran mikrob dan sebahagian besar air. Di sana, produk penapaian dipanaskan, jadi pecahan etanol menguap. Selepas itu, kita harus menghidangkan produk akhir penyulingan untuk mendapatkan sebahagian kecil daripada etanol. Di samping itu, pengeluaran etanol melalui cara kimia termasuk bertindak balas dengan stim.
Apa itu methoxymethane?
Methoxymethane adalah sebatian eter yang mempunyai formula kimia c2H6O. Nama biasa sebatian ini adalah dimetil eter. Kompaun ini terkenal dengan sifat pelarut. Ia mempunyai dua kumpulan metil yang terikat melalui atom oksigen; Kedua -dua kumpulan metil terikat dengan atom oksigen yang sama.
Jisim molar methoxymethane adalah 46.07 g/mol. Titik lebur bahan ini ialah -141 darjah Celsius manakala titik mendidih ialah -24 darjah Celsius. Ia berlaku sebagai gas tidak berwarna pada suhu bilik dan mempunyai bau seperti eter. Tambahan pula, dimetil eter tidak larut air.
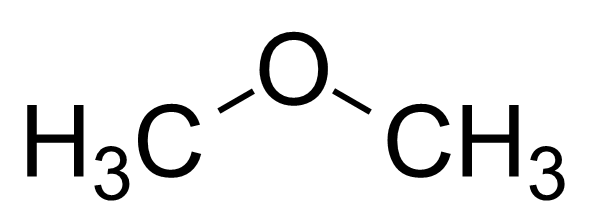
Rajah 02: Struktur kimia methoxymethane
Dimethyl Ether adalah sebatian bukan kutub. Ini bermaksud dimetil eter tidak mempunyai polaritas. Itu kerana struktur molekul simetri. Oleh itu, ia adalah pelarut yang baik untuk sebatian bukan polar. Walau bagaimanapun, ia tidak aktif secara kimia jika dibandingkan dengan sebatian organik lain.
Apakah perbezaan antara etanol dan methoxymethane?
Etanol dan methoxymethane mempunyai formula kimia yang sama tetapi struktur kimia yang berbeza, yang menentukan sifat kimia yang berbeza dari sebatian ini. Perbezaan utama antara etanol dan methoxymethane adalah bahawa etanol berlaku sebagai cecair tanpa warna yang sangat tidak menentu pada suhu bilik, sedangkan methoxymethane berlaku sebagai gas tidak berwarna pada suhu bilik.
Selain itu, etanol adalah alkohol dengan bau alkohol yang bersifat, sementara methoxymethane adalah eter yang mempunyai bau seperti eter. Selanjutnya, etanol dan methoxymethane mempunyai formula kimia yang sama yang disusun dalam struktur yang berbeza; Contohnya, etanol mempunyai kumpulan hidroksil (OH kumpulan) manakala methoxymethane tidak mempunyai kumpulan hidroksil.
Infographic di bawah membentangkan perbezaan antara etanol dan methoxymethane dalam bentuk tabular untuk perbandingan sampingan.
Ringkasan -etanol vs methoxymethane
Etanol atau etil alkohol adalah sebatian organik yang mempunyai formula kimia C2H5OH. Methoxymethane adalah sebatian eter yang mempunyai formula kimia C2H6O. Perbezaan utama antara etanol dan methoxymethane adalah bahawa etanol berlaku sebagai cecair tanpa warna yang sangat tidak menentu pada suhu bilik, sedangkan methoxymethane berlaku sebagai gas tidak berwarna pada suhu bilik.
Rujukan:
1. "Dimethyl Ether." Pusat Kebangsaan Maklumat Bioteknologi. Pangkalan Data Kompaun Pubchem, U.S. Perpustakaan Perubatan Negara.
Ihsan gambar:
1. "Ethanol-Alcohol-Protection--Covid-19" (CC0) melalui Pixabay
2. "Dimethyl eter tanpa pasangan tunggal" oleh B Levin13 - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia


