Apakah perbezaan antara tapak allosteric dan tapak aktif
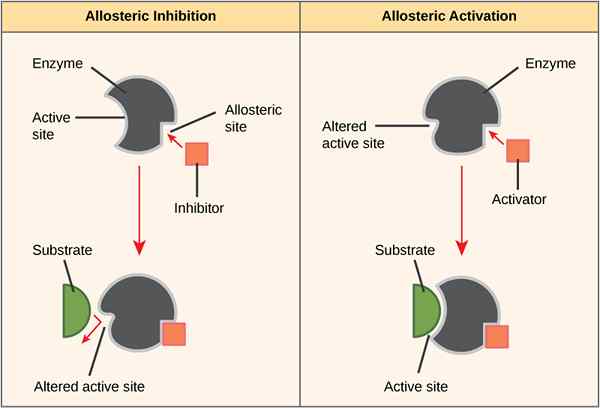
The Perbezaan utama antara tapak allosteric dan tapak aktif adalah bahawa tapak allosteric adalah kawasan enzim yang membolehkan pengaktif atau molekul perencat untuk mengikat enzim dan sama ada mengaktifkan atau menghalang aktiviti enzim, sementara tapak aktif adalah kawasan enzim di mana molekul substrat mengikat dan memangkin reaksi yang dihasilkan Pengeluaran produk tertentu.
Enzim adalah protein yang membantu tindak balas biokimia dalam tubuh manusia. Salah satu peranan enzim yang paling penting ialah pencernaan. Enzim juga membantu bernafas, membina otot, fungsi saraf, dan menyingkirkan toksin di dalam badan. Enzim mempunyai kawasan yang berbeza dalam struktur di mana molekul dapat mengikat dan memangkin tindak balas. Laman Allosteric dan Laman Aktif adalah dua kawasan yang berbeza dalam struktur enzim yang memudahkan molekul 'mengikat dan reaksi kimia berikutnya.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu laman web allosteric
3. Apa itu laman web yang aktif
4. Persamaan -Tapak Allosteric dan Tapak Aktif
5. Tapak allosteric vs tapak aktif dalam bentuk jadual
6. Ringkasan - Tapak Allosteric vs Laman Aktif
Apa itu laman web allosteric?
Tapak Allosteric adalah rantau enzim yang membolehkan pengaktif atau molekul perencat untuk mengikat enzim yang sama ada mengaktifkan atau menghalang aktiviti enzim. Enzim berfungsi pada suhu yang berbeza bergantung kepada persekitaran. Beberapa faktor, termasuk panas, dingin, pH, lokasi di dalam badan, dan bahan lain, mempengaruhi aktiviti enzim sebagai tambahan kepada substrat utama. Terdapat beberapa bahan yang mengikat enzim di tapak lain selain daripada tapak aktif biasa. Laman web ini yang membolehkan bahan lain mengikat dikenali sebagai tapak allosteric. Laman Allosteric Membenarkan bahan lain sama ada mengaktifkan, menghalang, atau mematikan aktiviti enzim. Ini berlaku apabila bahan lain mengikat ke tapak allosteric dan menukar pengesahan atau bentuk enzim.

Rajah 01: Laman Allosteric
Contoh pengaktif allosteric adalah pengikatan oksigen untuk hemoglobin. Mengikat oksigen allosteric ke hemoglobin mengubah pengesahan hemoglobin dan meningkatkan pertaliannya untuk lebih banyak oksigen. Proses ini memastikan hemoglobin akan mengangkut jumlah maksimum oksigen dari kawasan kaya oksigen seperti paru-paru. Satu lagi contoh perencat allosteric adalah ATP dalam pernafasan selular. Satu enzim penting yang terlibat dalam glikolisis ialah phosphofructokinase. Enzim ini menukar ADP ke ATP. Apabila terlalu banyak ATP di dalam sel, ATP berfungsi sebagai perencat allosteric yang mengikat ke tapak allosteric phosphofructokinase untuk melambatkan penukaran ADP ke ATP.
Apa itu laman web yang aktif?
Tapak aktif adalah rantau enzim di mana molekul substrat mengikat dan menjalani tindak balas untuk membuat produk. Tapak aktif dibahagikan lagi kepada dua tapak yang berbeza: tapak mengikat dan tapak kalalitik. Di tapak yang mengikat, sisa asid amino dari tapak aktif membentuk bon sementara dengan substrat. Sebaliknya, di tapak pemangkin, residu asid amino tapak aktif memangkinkan reaksi substrat tersebut.
Rajah 02: Laman aktif
Tapak aktif enzim biasanya mempunyai tiga hingga empat asid amino, sementara asid amino lain dalam enzim diperlukan untuk mengekalkan struktur tertiari enzim. Tapak aktif enzim dapat memangkinkan tindak balas berulang kali sebagai sisa tidak berubah pada akhir reaksi. Proses ini dicapai secara normal dengan menurunkan tenaga pengaktifan reaksi. Oleh itu, lebih banyak substrat mempunyai tenaga yang mencukupi untuk menjalani tindak balas kimia.
Apakah persamaan antara tapak allosteric dan tapak aktif?
- Tapak allosteric dan tapak aktif adalah dua kawasan yang berbeza dalam struktur enzim yang memudahkan molekul 'mengikat dan reaksi kimia berikutnya.
- Kedua -dua tapak terdiri daripada asid amino.
- Laman web ini mempunyai bentuk yang unik.
- Kedua-dua laman web ini sangat penting untuk aktiviti enzim dan reaksi enzim-catalyzed.
Apakah perbezaan antara tapak allosteric dan tapak aktif?
Tapak allosteric adalah kawasan enzim yang membolehkan pengaktif atau molekul perencat untuk mengikat enzim untuk mengaktifkan atau menghalang aktiviti enzim, sementara tapak aktif adalah kawasan enzim di mana molekul substrat mengikat dan memangkinkan reaksi yang mengakibatkan pengeluaran produk tertentu. Oleh itu, ini adalah perbezaan utama antara tapak allosteric dan tapak aktif. Tambahan pula, tapak allosteric hanya terdapat dalam enzim allosteric, sementara tapak aktif hadir dalam semua enzim.
Infographic di bawah membentangkan perbezaan antara tapak allosteric dan tapak aktif dalam bentuk tabular untuk perbandingan sampingan.
Ringkasan -Tapak Allosteric vs Laman Aktif
Tapak Allosteric dan Tapak Aktif adalah dua kawasan yang berbeza dalam struktur enzim. Tapak allosteric adalah kawasan enzim yang membolehkan pengaktif atau molekul perencat untuk mengikat enzim yang sama ada mengaktifkan atau menghalang aktiviti enzim, sementara tapak aktif adalah rantau enzim di mana molekul substrat mengikat dan memangkinkan reaksi yang mengakibatkan pengeluaran tertentu produk. Jadi, ini adalah perbezaan utama antara tapak allosteric dan tapak aktif.
Rujukan:
1. "Tapak Aktif."Gambaran Keseluruhan | Topik Sciencedirect.
2. "Apakah tapak enzim allosteric? - Definisi & Biologi."Kajian.com.
Ihsan gambar:
1. "Rajah 06 05 05" oleh CNX OpenStax - (CC oleh 4.0) melalui Commons Wikimedia
2. "SI Active Site" oleh AreID3 - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


