Perbezaan antara solvolisis dan aminolisis
The Perbezaan utama Antara solvolisis dan aminolisis ialah Solvolisis boleh menjadi tindak balas tambahan atau penggantian, sedangkan aminolisis adalah tindak balas penggantian.
Solvolisis dan aminolisis adalah tindak balas yang melibatkan belahan ikatan kimia. Inilah sebabnya mereka dinamakan dengan akhiran "-lysis". Bergantung pada keadaan tindak balas, awalan berbeza antara satu sama lain; Dalam solvolisis, terdapat pelarut sebagai nukleofil manakala dalam aminolisis, ammonia atau amina adalah komponen penting.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah solvolisis
3. Apa itu aminolisis
4. Perbandingan sampingan -solvolisis vs aminolisis dalam bentuk jadual
5. Ringkasan
Apakah solvolisis?
Solvolisis adalah tindak balas kimia yang sama ada penambahan nukleofilik atau penggantian nukleofilik di mana nukleofil adalah pelarut. Apabila mempertimbangkan jenis tindak balas penggantian nukleofilik, kita dapat memerhatikannya sebagai tindak balas SN1 atau SN2.

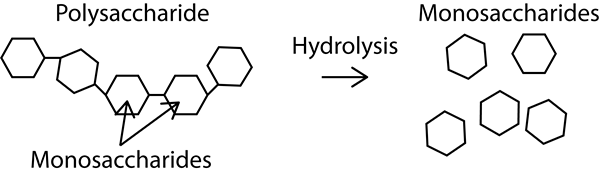
Rajah 01: Hidrolisis adalah jenis tindak balas solvolisis di mana pelarut adalah air
Sebagai ciri tindak balas solvolisis SN1, sebatian kiral bertindak sebagai reaktan yang memberikan racemate yang terbentuk dari reaksi. Kita boleh mengklasifikasikan tindak balas solvolisis bergantung kepada jenis pelarut yang digunakan untuk reaksi. Sebagai contoh, jika kita menggunakan air sebagai pelarut, maka ia adalah hidrolisis. Begitu juga, jika kita menggunakan alkohol sebagai pelarut, maka ia adalah alkohol; Jika kita menggunakan ammonia, maka ia adalah ammonolisis, dll.
Apa itu aminolisis?
Aminolisis adalah tindak balas kimia di mana sebatian kimia bertindak balas dengan sama ada ammonia atau kumpulan amina, yang menyebabkan molekul itu berpisah. Di sini, tindak balas penggantian berlaku (kumpulan amina menggantikan sebahagian daripada molekul reaktan). Sekiranya reaktan bertindak balas dengan ammonia, nama khusus untuk reaksi itu adalah ammonolisis.
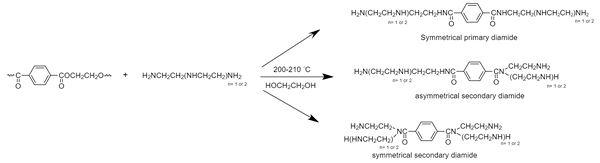
Rajah 02: Degradasi Binatang Memberi Tiga Produk Berbeza
Terdapat pelbagai jenis tindak balas aminolisis termasuk penggantian halida dalam sebatian alkil dengan kumpulan amina, sintesis peptida, sintesis amida dari asid karboksilik, dan lain -lain. Reaksi aminolisis berguna dalam degradasi PET di mana kita boleh mendapatkan tiga produk yang berbeza yang simetri dan asimetris.
Apakah perbezaan antara solvolisis dan aminolisis?
Solvolisis dan aminolisis adalah tindak balas yang melibatkan belahan ikatan kimia. Itulah sebab untuk menamakan mereka dengan akhiran "-lysis". Bergantung pada keadaan tindak balas, awalan berbeza antara satu sama lain; Dalam solvolisis, terdapat pelarut sebagai nukleofil, manakala dalam aminolisis, ammonia atau amina adalah komponen penting. Tambahan pula, perbezaan utama antara solvolisis dan aminolisis ialah solvolisis boleh sama ada tindak balas tambahan atau penggantian, tetapi aminolisis adalah tindak balas penggantian. Selain itu, terdapat pelbagai jenis tindak balas solvolisis seperti hidrolisis, alkohol, ammonolisis, aminolisis, dan lain -lain. Begitu juga, terdapat pelbagai jenis aminolisis seperti penggantian halida dalam alkil halida, sintesis peptida, sintesis amida dari asid karboksilik, dan lain -lain.
Di bawah infographic tabulasi perbezaan antara solvolisis dan aminolisis.
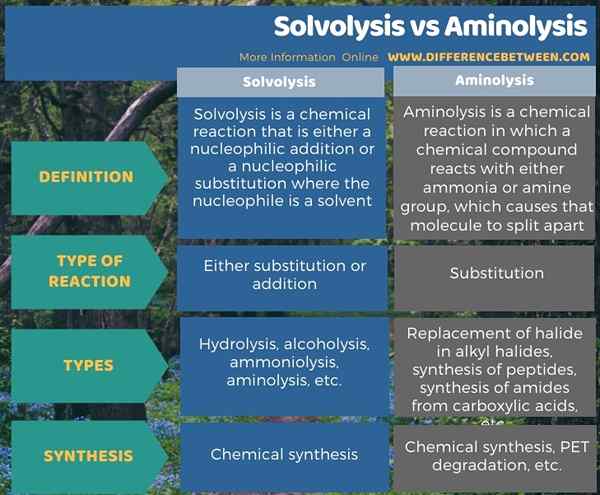
Ringkasan -Solvolisis vs aminolisis
Solvolisis dan aminolisis adalah tindak balas yang melibatkan belahan ikatan kimia. Itulah sebab untuk menamakan mereka dengan akhiran "-lysis". Bergantung pada keadaan tindak balas, awalan berbeza antara satu sama lain; Dalam solvolisis, terdapat pelarut sebagai nukleofil, manakala dalam aminolisis, ammonia atau amina adalah komponen penting. Selain itu, perbezaan utama antara solvolisis dan aminolisis ialah solvolisis boleh sama ada tindak balas tambahan atau penggantian, tetapi aminolisis adalah tindak balas penggantian.
Rujukan:
1."Solvolysis." Wikipedia, Yayasan Wikimedia, 29 Mei 2019, boleh didapati di sini.
2. "Aminolisis." Wikipedia, Yayasan Wikimedia, 1 Dis. 2019, boleh didapati di sini.
Ihsan gambar:
1. "Hydrolysis Polysaccharide Mudah" oleh Sarah Greenwood - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia
2. "Degradasi haiwan dengan poliamina melalui laluan aminolisis" oleh Fong-Wind-Kerja Sendiri (CC BY-SA 4.0) melalui Commons Wikimedia


