Perbezaan antara model Bohr dan Rutherford
Perbezaan Utama - Model Bohr vs Rutherford
Konsep atom dan struktur mereka mula diperkenalkan oleh John Dolton pada tahun 1808. Dia menjelaskan undang -undang kombinasi kimia dengan mempertimbangkan atom sebagai zarah yang tidak kelihatan tanpa struktur. Kemudian pada tahun 1911, ahli fizik New Zealand Ernest Rutherford mencadangkan bahawa atom terdiri daripada dua komponen: nukleus yang dikenakan positif di tengah atom dan elektron yang dikenakan secara negatif di bahagian extranuklear atom. Teori -teori tertentu seperti teori elektromagnet yang dibentangkan oleh Maxwell tidak dapat dijelaskan dengan model Rutherford. Kerana batasan seperti dalam model Rutherford, ahli fizik Denmark Niels Bohr mencadangkan model baru pada tahun 1913 berdasarkan teori kuantum radiasi. Model Bohr sebahagian besarnya diterima dan dia dianugerahkan Hadiah Nobel untuk karyanya. Walaupun ia sebahagian besarnya diterima, ia masih membawa kelemahan dan batasan tertentu. Perbezaan utama antara model Bohr dan model Rutherford ialah Dalam model Rutherford, elektron boleh berputar di mana -mana orbit di sekitar nukleus, sedangkan dalam model Bohr, elektron boleh berputar dalam cangkang pasti.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu model bohr
3. Apakah model Rutherford
4. Perbandingan sampingan - Model Bohr vs Rutherford dalam bentuk jadual
6. Ringkasan
Apa itu model bohr?
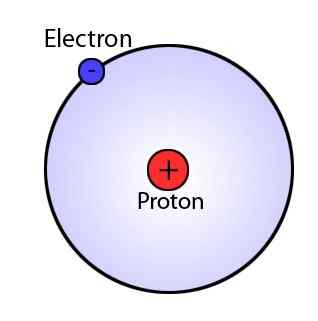
Model Bohr dicadangkan oleh Niels Bohr pada tahun 1922 untuk menjelaskan struktur atom. Dalam model ini, Bohr menyebut bahawa sebahagian besar jisim atom terletak pada nukleus pusat yang mengandungi proton dan elektron diatur dalam tahap tenaga yang pasti dan berputar di sekitar nukleus. Model ini juga mencadangkan konfigurasi elektronik, yang menerangkan susunan elektron dalam orbit bulat yang ditetapkan sebagai k, l, m, n, dll. Atom dengan konfigurasi elektron lengkap tidak aktif. Konfigurasi elektron menentukan kereaktifan atom.

Rajah 01: Model Bohr
Model Bohr dapat menjelaskan spektrum atom hidrogen, tetapi ia tidak dapat menjelaskan sepenuhnya kereaktifan atom multielektron. Selain itu, ia tidak menjelaskan kesan zeeman, di mana setiap garis spektrum berpecah kepada lebih banyak garis di hadapan medan magnet luaran. Dalam model ini, elektron dianggap hanya sebagai zarah. Walau bagaimanapun, ahli fizik Perancis, de Broglie mendapati bahawa elektron mempunyai kedua -dua gelombang dan sifat zarah. Kemudian, seorang ahli fizik mengemukakan prinsip lain yang disebut prinsip ketidakpastian Heisenberg, yang menjelaskan kemustahilan penentuan serentak kedudukan tepat dan momentum zarah bergerak kecil seperti elektron. Dengan ciptaan ini, model Bohr menghadapi kemunduran yang serius.
Apakah model Rutherford?
Pada tahun 1911, Ernest Rutherford mencadangkan model Rutherford. Ia menyatakan bahawa atom (kelantangan) terdiri terutamanya dari ruang dan jisim atom berpusat di nukleus, yang merupakan teras atom. Nukleus dicas secara positif dan orbit elektron di sekitar nukleus. Orbit tidak mempunyai jalan yang pasti. Selain itu, kerana atom adalah neutral, mereka mempunyai positif yang sama (dalam nukleus) dan caj negatif (elektron).

Rajah 02: Atom Rutherford
Model Rutherford gagal menjelaskan teori elektromagnet, kestabilan atom dan kewujudan garis pasti dalam spektrum hidrogen.
Apakah perbezaan antara model Bohr dan Rutherford?
Model Bohr vs Rutherford | |
| Model Bohr dicadangkan oleh Niels Bohr pada tahun 1922. | Model Rutherford dicadangkan oleh Ernest Rutherford pada tahun 1911. |
| Teori | |
| Kebanyakan jisim atom terletak pada nukleus pusat, yang mengandungi proton, dan elektron disusun dalam tahap tenaga atau cengkerang yang pasti. | Sebilangan besar atom terdiri daripada ruang kosong. Pusat atom mengandungi nukleus yang dikenakan positif dan elektron yang dikenakan secara negatif hadir di ruang yang mengelilingi nukleus. |
| Pelepasan sinaran elektron | |
| Elektron hanya memancarkan gelombang frekuensi pasti. | Elektron memancarkan gelombang semua frekuensi. |
| Spektrum pelepasan elektron | |
| Spektrum pelepasan elektron adalah spektrum garis. | Spektrum pelepasan elektron adalah spektrum berterusan. |
Ringkasan -Model Bohr vs Rutherford
Kedua -dua model Bohr dan Rutherford adalah model planet yang menerangkan struktur atom sehingga tahap tertentu. Model -model ini mempunyai batasan dan tidak menjelaskan beberapa prinsip fizik moden. Walau bagaimanapun, model -model ini sangat menyumbang kepada model maju moden yang menjelaskan struktur atom. Model Bohr menyatakan bahawa kebanyakan jisim atom berada di nukleus pusat, yang mengandungi proton dan, bahawa elektron disusun dalam tahap tenaga atau cengkerang yang pasti, mengakibatkan spektrum garis elektron. Model Rutherford menyatakan bahawa kebanyakan atom terdiri daripada ruang kosong dan pusat atom mengandungi nukleus yang dikenakan positif yang dikelilingi oleh elektron yang dikenakan secara negatif, mengakibatkan spektrum elektron berterusan. Ini adalah perbezaan antara model Bohr dan Rutherford.
Muat turun Versi PDF Model Bohr vs Rutherford
Anda boleh memuat turun versi PDF artikel ini dan menggunakannya untuk tujuan luar talian mengikut nota petikan. Sila muat turun versi PDF di sini perbezaan antara model Bohr dan Rutherford.
Rujukan:
1. Tarendash, a. S. Mari kita tinjau: Kimia, tetapan fizikal. Siri Pendidikan Barron, 2006. Cetak.
2. Warren, d. Ahli kimia dalam konteks sosial dan sejarah: Ahli kimia adalah orang sebenar, tinggal di dunia nyata. Royal Society of Chemistry, 2001. Cetak.
Ihsan gambar:
1. "Model Bohr" oleh Jia.Liu - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia
2. "Rutherford Atom" oleh karya sendiri (CreateJoder XD XD) (CC BY-SA 3.0) melalui Commons Wikimedia