Perbezaan antara undang -undang kadar dan undang -undang tindakan massa
Perbezaan utama - Kadar undang -undang vs undang -undang tindakan massa
The Perbezaan utama antara undang -undang kadar dan undang -undang tindakan jisim adalah bahawa Kadar undang -undang menunjukkan hubungan antara kadar tindak balas kimia dan kepekatan reaktan manakala undang -undang tindakan massa menyatakan bahawa kadar tindak balas kimia adalah berkadar dengan massa bahan yang bertindak balas.
Kadar undang -undang adalah undang -undang dalam kimia yang digunakan untuk menjelaskan tingkah laku campuran tindak balas. Undang -undang kadar menunjukkan bahawa kadar tindak balas adalah berkadar terus dengan kadar tindak balas. Pemalar perkadaran dikenali sebagai pemalar kadar. Undang -undang tindakan massa menunjukkan bahawa kadar tindak balas tindak balas kimia berkadar terus dengan produk massa reaktan yang dinaikkan kepada kuasa (ia sering sama dengan pekali stoikiometrik mereka dalam persamaan kimia) yang ditentukan secara eksperimen.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu undang -undang kadar
3. Apakah undang -undang tindakan massa
4. Perbandingan sampingan - Kadar undang -undang vs undang -undang tindakan massa dalam bentuk jadual
5. Ringkasan
Apa itu undang -undang kadar?
Undang -undang kadar menunjukkan hubungan antara kadar tindak balas kimia dan kepekatan reaktan. Mengikut undang -undang kadar, kadar tindak balas adalah berkadar terus dengan kepekatan reaktan yang dibangkitkan kepada kuasa (ia sering sama dengan hubungan stoikiometrik dalam persamaan kimia) yang ditentukan secara eksperimen.
Undang -undang kadar boleh didapati dalam dua jenis seperti berikut:
- Undang -undang Kadar Berbeza
Undang -undang kadar pembezaan memberikan kadar tindak balas sebagai fungsi perubahan kepekatan reaktan dalam tempoh masa tertentu.
- Undang -undang kadar bersepadu
Undang -undang kadar bersepadu memberikan kadar tindak balas sebagai fungsi kepekatan awal reaktan pada masa tertentu.
Marilah kita mempertimbangkan contoh untuk memahami perkara ini.
AA +BB → CC +DD
Kadar = k [a]a[B]b
Persamaan di atas memberikan ungkapan matematik undang -undang kadar. Di sana, "k" adalah pemalar perkadaran. Ia dikenali sebagai pemalar kadar. Eksponen "A" dan "B" adalah perintah tindak balas berkenaan dengan reaktan A dan B masing -masing. Perintah keseluruhan (p) tindak balas diberikan sebagai jumlah semua perintah dalam persamaan undang -undang kadar.
p = a + b

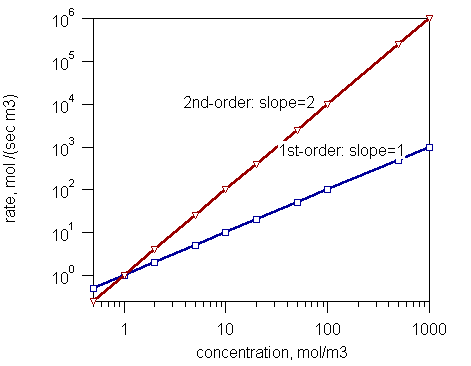
Rajah 1: Kadar tindak balas dan kepekatan tindak balas pesanan pertama dan tindak balas pesanan kedua.
Berdasarkan urutan keseluruhan tindak balas, reaksi dalam tiga jenis sebagai:
- Reaksi Pesanan Zero - Kadar tindak balas bebas daripada kepekatan reaktan
- Reaksi pesanan pertama - Kadar tindak balas adalah berkadar dengan kepekatan satu reaktan.
- Reaksi pesanan kedua - Kadar tindak balas adalah berkadar sama dengan produk kepekatan dua reaktan atau ke kuadrat kepekatan satu reaktan.
Apakah undang -undang tindakan massa?
Undang -undang Tindakan Massa menunjukkan bahawa kadar tindak balas kimia adalah berkadar dengan massa bahan yang bertindak balas. Ia juga dikenali sebagai Undang -undang Tindakan Massa. Undang -undang ini berguna untuk mendapatkan persamaan keseimbangan yang tepat dari tindak balas kimia tertentu. Undang -undang juga diberikan oleh aktiviti atau kepekatan reaktan. Mengikut undang -undang tindakan massa, nisbah antara kepekatan produk dan reaktan adalah malar dalam campuran tindak balas yang berada dalam keadaan keseimbangan.
Undang -undang Tindakan Massa adalah konsep sejagat, yang bermaksud, ia boleh digunakan untuk mana -mana sistem dalam keadaan apa pun. Undang -undang ini boleh diberikan dalam ungkapan matematik seperti di bawah.
Untuk reaksi,
AA +BB ↔ CC +DD
Nisbah antara produk dan reaktan pada keseimbangan;
Keq = [c]c[D]d / [A]a[B]b
Pada suhu tertentu, nisbah di atas adalah malar untuk keseimbangan antara reaktan (A dan B) dan produk (C dan D). Di sini, keq dikenali sebagai pemalar keseimbangan.
Apakah perbezaan antara undang -undang kadar dan undang -undang tindakan massa?
Menilai undang -undang vs undang -undang tindakan massa | |
| Undang -undang kadar menunjukkan bahawa kadar tindak balas adalah berkadar terus dengan kepekatan reaktan yang dibangkitkan kepada kuasa yang ditentukan secara eksperimen. | Undang -undang Tindakan Massa menunjukkan bahawa kadar tindak balas kimia adalah berkadar dengan massa bahan yang bertindak balas. |
| Komponen persamaan | |
| Persamaan undang -undang kadar mempunyai kadar pemalar, kepekatan reaktan dan urutan tindak balas. | Undang -undang Tindakan Massa mempunyai persamaan yang terdiri daripada kepekatan produk dan reaktan yang dibangkitkan kepada kuasa pekali stoikiometrik mereka. |
| Produk | |
| Persamaan undang -undang kadar tidak mengandungi kepekatan produk. | Undang -undang persamaan tindakan massa mengandungi kepekatan produk. |
| Komponen proporsional | |
| Pemalar perkadaran persamaan undang -undang kadar dikenali sebagai pemalar kadar "k". | Tidak ada perkadaran yang berterusan dalam undang -undang persamaan tindakan massa. |
Ringkasan - Kadar undang -undang vs undang -undang tindakan massa
Menilai undang -undang dan undang -undang tindakan massa digunakan untuk menjelaskan tingkah laku campuran tindak balas. Perbezaan utama antara undang -undang kadar dan undang -undang tindakan massa adalah bahawa undang -undang kadar menunjukkan hubungan antara kadar tindak balas kimia dan kepekatan reaktan manakala undang -undang tindakan massa menunjukkan bahawa kadar tindak balas kimia adalah berkadar dengan kepekatan bahan yang bertindak balas.
Rujukan:
1. "Undang -undang kadar."Kimia Libretexts, 21 Julai 2016, boleh didapati di sini.
2. "12.3 undang -undang kadar."Kimia, boleh didapati di sini.
3. Laidler, Keith J. "Undang -undang Tindakan Massa."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 26 Okt. 2016, boleh didapati di sini.
Ihsan gambar:
1. "Rateloglogplot" oleh Fabiuccio ~ Enwikibooks di Wikibooks Bahasa Inggeris - dipindahkan dari en.Wikibooks ke Commons., (Domain Awam) melalui Wikimedia Commons


