Perbezaan antara pH dan pOH
Perbezaan utama - pH vs poh
Istilah pH dan pOH digunakan untuk menyatakan jumlah h+ Dan oh- ion hadir dalam larutan berair. Ungkapan ini diberikan sebagai tolak nilai log kepekatan larut. pH merujuk kepada "potensi hidrogen". Ia boleh digunakan untuk menentukan sama ada penyelesaian berasid, asas atau neutral. Sebaliknya, POH adalah ukuran ion hidroksida (OH-) kepekatan. The Perbezaan utama antara pH dan pOH ialah pH adalah ukuran ion hidrogen manakala POH adalah ukuran ion hidroksida.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu pH
3. Apa itu POH
4. Hubungan antara pH dan poh
5. Perbandingan sampingan - pH vs pOH dalam bentuk jadual
6. Ringkasan
Apa itu pH?
pH adalah angka yang menyatakan keasidan atau kealkalian penyelesaian pada skala logaritma di mana 7 adalah neutral. Nilai yang lebih rendah daripada 7 lebih berasid manakala nilai yang lebih tinggi lebih banyak alkali. PH sama dengan -log10 C, di mana C ialah kepekatan ion hidrogen dalam tahi liter seliter.
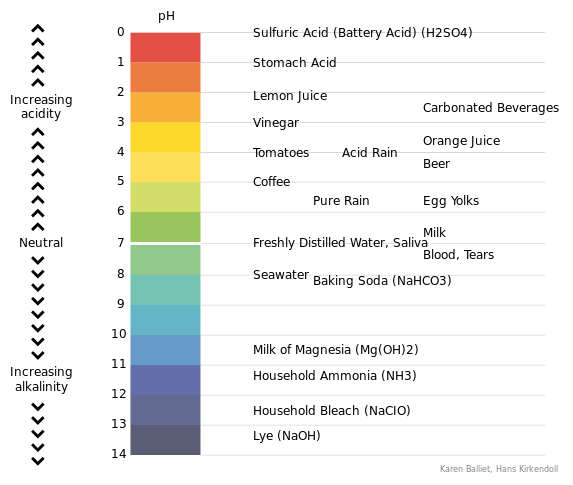
Skala pH berjalan dari 1 hingga 14. Nilai pH 1 hingga 6 diiktiraf sebagai nilai pH berasid. Nilai pH dari 8 hingga 14 diiktiraf sebagai nilai pH asas. PH 7 dianggap sebagai pH neutral. Sebagai contoh, asid kuat mempunyai nilai pH berhampiran pH = 1 manakala pangkalan yang kuat mempunyai nilai pH berhampiran pH = 14. "P" dalam istilah pH merujuk kepada logaritma negatif. Secara umum, logaritma negatif konsert ion hidrogen (atau pH) digunakan dan bukannya menggunakan kepekatan ion hidrogen. Itu kerana, kebanyakan masa, kepekatan ion hidrogen sangat rendah atau sangat besar, oleh itu, dengan menggunakan pH menjadikannya lebih mudah untuk bekerja dengan nilai -nilai kecil atau besar seperti itu.

Rajah 01: Skala pH
Dalam larutan akueus, molekul air memisahkan ion hidrogen dan ion hidroksida. Oleh itu, semua badan air semula jadi mempunyai nilai pH tertentu. PH sistem diberikan oleh persamaan berikut.
ph = -log10 [H+]
Terdapat petunjuk yang dikenali sebagai petunjuk pH yang digunakan untuk menunjukkan titik akhir tindak balas asid. Petunjuk ini dapat mengubah warna medium tindak balas dengan perubahan pH. Sebagai contoh, penunjuk phenolphthalein mempunyai warna merah jambu dalam nilai pH asas (kira -kira pH = 10.0), tetapi tidak berwarna di sekitar pH = 8.3.
Apa itu POH?
poh adalah ukuran ion hidroksida (oh-) kepekatan. Oleh itu, poh adalah ukuran kealkalian penyelesaian. "P" dalam istilah POH merujuk kepada logaritma negatif. Oleh itu, POH adalah logaritma negatif kepekatan ion hidroksida dalam larutan.
ph = -log10 [Oh-]
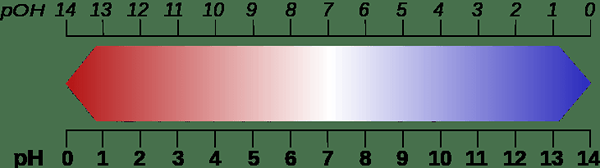
Rajah 02: Perbandingan skala pH dan POH
Oleh kerana istilah ini memberikan bilangan ion hidroksida yang terdapat dalam larutan akueus, ia adalah ukuran asas (kealkalian). Contohnya, nilai POH kurang daripada pOH = 7 (pada 25oC) adalah alkali. Kemudian, jika penyelesaian mempunyai nilai POH di antara 1 hingga 6, penyelesaiannya lebih banyak alkali. poh = 7 dianggap sebagai neutral. Tetapi nilai POH lebih tinggi daripada 7 diiktiraf sebagai keadaan berasid.
Apakah hubungan antara pH dan pOH?
Untuk pemisahan air, pemalar pemisahan diberikan seperti di bawah.
H2O ⇆ h+ + Oh-
Kw = [H+] [OH-]
Di mana kw adalah pemisahan air, [h+] adalah konsert ion hidrogen dan [oh-] adalah kepekatan ion hidroksida. Tetapi untuk air tulen, [h+] = [Oh-] = 1 × 10-7mol/l. Kemudian, apabila logaritma negatif diambil untuk setiap istilah dalam persamaan di atas,
pkw = ph + pOH
pkw = 7 + 7
pkw = 14
maka jika hanya pH diketahui, nilai pOH dapat diperoleh menyanyi di atas hubungan.
Walau bagaimanapun, dalam skala pH dan POH, 7 adalah neutral.
Apakah perbezaan antara pH dan pOH?
pH vs pOH | |
| pH mengekspresikan keasidan atau kealkalian penyelesaian pada skala logaritma di mana 7 adalah neutral. | poh adalah ukuran ion hidroksida (oh-) kepekatan. poh = 7 dianggap sebagai neutral |
| Ungkapan | |
| pH memberikan logaritma negatif kepekatan ion hidrogen. | POH memberikan logaritma negatif kepekatan ion hidroksida. |
| Nilai berasid | |
| Skala pH memberikan nilai berasid dari 1 hingga 6. | Skala POH memberikan nilai berasid dari 8 hingga 14. |
| Nilai alkali | |
| Skala pH memberikan nilai asas dari 8 hingga 14. | Skala POH memberikan nilai asas dari 1 hingga 6. |
Ringkasan - pH vs poh
pH dan pOH adalah dua istilah yang digunakan untuk menyatakan keasidan atau kealkalian penyelesaian. Perbezaan utama antara pH dan POH ialah pH adalah ukuran ion hidrogen manakala POH adalah ukuran ion hidroksida.
Muat turun pdf ph vs pOH
Anda boleh memuat turun versi PDF artikel ini dan menggunakannya untuk tujuan luar talian mengikut nota petikan. Sila muat turun versi PDF di sini: Perbezaan antara pH dan pOH
Rujukan:
1.Helmenstine, Anne Marie, D. "Definisi POH (Kimia)."Thoughtco, Jul. 24, 2017. Terdapat di sini
2.Helmenstine, Anne Marie, D. "Cara mencari POH dalam Kimia."Thoughtco, Jan. 29, 2018. Terdapat di sini
Ihsan gambar:
1.'Kuasa Hidrogen (PH) Chart'by Hans Kirkendoll - Kerja Sendiri, (Domain Awam) melalui Commons Wikimedia
2.'Phscalenolang'by Phscalenolang.PNG - Kerja Sendiri (CC BY -SA 2.5) Melalui Wikimedia Commons


