Perbezaan antara monovalen dan divalen
The Perbezaan utama antara monovalen dan divalen adalah bahawa Unsur -unsur monovalen dapat menghapuskan atau memperoleh satu elektron untuk menjadi stabil, sedangkan unsur -unsur divalen dapat menghapuskan atau memperoleh dua elektron untuk menjadi stabil.
Istilah monovalen dan divalen dapat menggambarkan valensi elemen kimia. Kedua -dua istilah ini menerangkan bilangan elektron atom yang dapat memperoleh atau kehilangan untuk mencapai konfigurasi elektron yang stabil.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Valency
3. Apa itu monovalent
4. Apa yang divalen
5. Perbandingan sampingan - monovalen vs divalen dalam bentuk jadual
6. Ringkasan
Apa itu Valency?
Valency boleh digambarkan sebagai bilangan maksimum elektron atom boleh kehilangan, memperoleh atau berkongsi untuk menjadi stabil. Apabila mempertimbangkan logam dan bukan logam, peraturan oktet menerangkan bentuk atom yang paling stabil. Menurut peraturan oktet, jika cangkang paling luar atom dipenuhi dengan lapan elektron, konfigurasi itu stabil. Ini bermakna jika sub-orbital S dan P dipenuhi sepenuhnya, mempunyai NS2np6, Konfigurasi elektron ini stabil. Umumnya, atom gas mulia mempunyai konfigurasi elektron jenis ini. Ini menunjukkan bahawa elemen kimia lain perlu sama ada kehilangan, memperoleh atau berkongsi elektron untuk mematuhi peraturan oktet. Bilangan maksimum elektron yang terlibat dalam proses penstabilan ini dipanggil valensi atom itu.
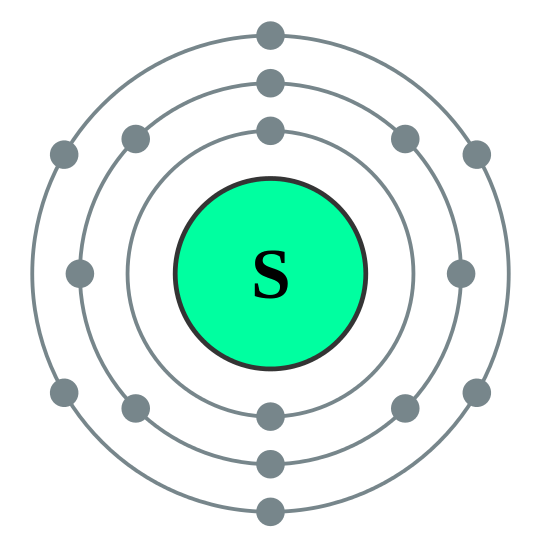
Contohnya, bilangan elektron di orbital paling luar sulfur adalah 6. Untuk menjadi stabil, bilangan elektron di orbital paling luar mestilah 8 (mengikut peraturan oktet). Sulfur mesti memperoleh atau berkongsi dua lagi elektron dari luar. Oleh itu, valensi belerang adalah 2.
Walau bagaimanapun, elemen peralihan boleh mempunyai valensi yang berbeza. Ini kerana logam peralihan dapat stabil dengan mengeluarkan bilangan elektron yang berlainan.
Apa itu monovalent?
Istilah monovalen bermaksud mempunyai valensi satu. Istilah lain untuk nama ini adalah tidak berubah, Maksudnya, "Valency = One". Atom monovalen dapat membentuk satu ikatan kimia kerana atom -atom ini dapat kehilangan atau memperoleh hanya satu elektron untuk menjadi stabil. Beberapa atom cenderung untuk berkongsi elektron tunggal ini, membentuk satu ikatan kovalen tunggal, e.g. kebanyakan bukan metals. Tetapi sesetengah atom cenderung menghapuskan atau mendapatkan elektron sepenuhnya, membentuk ikatan ionik, e.g. logam. Unsur -unsur kimia dalam kumpulan 1 jadual berkala (logam alkali) biasanya monovalen kerana mereka hanya boleh kehilangan satu elektron yang berada di orbital paling luar.
Apa yang divalen?
Istilah divalen bermaksud mempunyai valensi dua. Atom divalen boleh membentuk dua ikatan kimia kerana atom -atom ini boleh kehilangan atau memperoleh dua elektron untuk mendapatkan konfigurasi elektron yang stabil. Beberapa atom divalen cenderung membentuk dua ikatan kovalen tunggal dengan berkongsi kedua -dua elektron ini dengan dua atom yang berbeza. Beberapa atom cenderung membentuk ikatan berganda dengan atom lain dengan berkongsi kedua -dua elektron ini. Walau bagaimanapun, kumpulan 2 logam dalam jadual berkala cenderung membentuk ikatan ionik dengan anion divalen dengan menghapuskan dua elektron yang berada di orbital atom S yang paling luar.
Apakah perbezaan antara monovalen dan divalen?
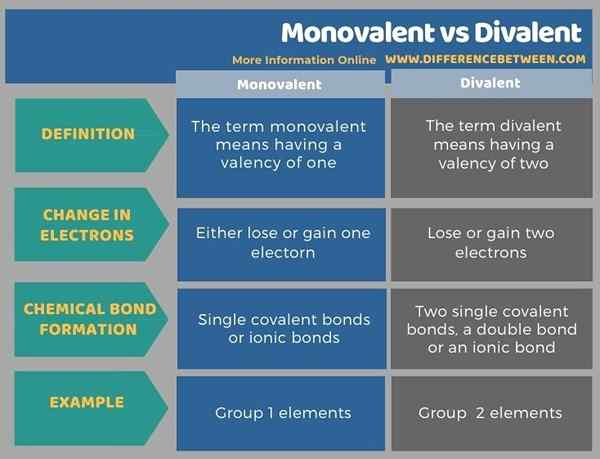
Istilah monovalen dan divalen adalah kata sifat yang menggambarkan valensi atom. Perbezaan utama antara monovalen dan divalen adalah bahawa unsur -unsur monovalen dapat menghapuskan atau memperoleh satu elektron untuk menjadi stabil, sedangkan unsur -unsur divalen dapat menghapuskan atau memperoleh dua elektron untuk menjadi stabil. Selain itu, unsur -unsur kimia dalam kumpulan 1 jadual berkala (logam alkali) biasanya monovalen manakala unsur -unsur dalam kumpulan 2 jadual berkala adalah divalen.
Berikut adalah tabulasi ringkasan perbezaan antara monovalen dan divalen.
Ringkasan -Monovalent vs Divalent
Istilah monovalen dan divalen adalah kata sifat yang menggambarkan valensi atom. Perbezaan utama antara monovalen dan divalen adalah bahawa unsur -unsur monovalen dapat menghapuskan atau memperoleh satu elektron untuk menjadi stabil, sedangkan unsur -unsur divalen dapat menghapuskan atau memperoleh dua elektron untuk menjadi stabil.
Rujukan:
1. "Valensi (Kimia)." Wikipedia, Yayasan Wikimedia, 1 Sept. 2020, boleh didapati di sini.
Ihsan gambar:
1. "Electron Shell 016 Sulfur" oleh Pumbaa (karya asal oleh Greg Robson) - Aplikasi: (Dihasilkan oleh Skrip) (CC BY -SA 2.0 uk) melalui Commons Wikimedia


