Perbezaan antara molekul dan kekisi

The Perbezaan utama antara molekul dan kekisi ialah a Molekul mengandungi atom yang terikat antara satu sama lain sedangkan kisi mengandungi atom, molekul atau ion yang terikat antara satu sama lain.
Atom bergabung bersama untuk membentuk pelbagai bahan kimia. Mengikut susunan mereka, sifat mereka berubah. Unit paling mudah yang boleh terbentuk apabila atom mengikat antara satu sama lain adalah molekul. Sekiranya sejumlah besar atom, ion atau molekul bergabung antara satu sama lain, maka hasilnya adalah kekisi. Kekisi mempunyai struktur yang sangat diperintahkan dan jisim molar yang sangat tinggi.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu molekul
3. Apa itu kekisi
4. Perbandingan sampingan - molekul vs kekisi dalam bentuk jadual
5. Ringkasan
Apa itu molekul?
Molekul terdiri daripada dua atau lebih atom yang terikat secara kimia (e.g., O2, N2) atau elemen yang berbeza (h2O, NH3). Molekul tidak mempunyai caj, dan atom mengikat antara satu sama lain melalui ikatan kovalen. Selain itu, mereka boleh menjadi sangat besar (hemoglobin) atau sangat kecil (h2), bergantung pada bilangan atom yang saling berhubung.

Rajah 01: Molekul air
Formula molekul molekul menunjukkan jenis dan bilangan atom dalam molekul. Formula empirikal memberikan nisbah integer paling mudah atom yang terdapat dalam molekul. Contohnya, c6H12O6 adalah formula molekul glukosa, dan CH2O adalah formula empirikal. Jisim molekul adalah jisim yang kita hitung memandangkan jumlah atom dalam formula molekul. Tambahan pula, setiap molekul mempunyai geometri sendiri. Selain itu, atom dalam molekul mengatur dengan cara yang paling stabil dengan sudut ikatan tertentu dan panjang ikatan untuk meminimumkan penolakan dan daya ketegangan.
Apa itu kekisi?
Kekisi adalah rangkaian atom yang besar yang mempunyai struktur yang diperintahkan. Dalam kimia, kita dapat melihat pelbagai jenis kisi ionik dan kovalen. Kita boleh menentukan kekisi sebagai pepejal yang mempunyai susunan tiga dimensi yang diperintahkan oleh unit asas. Unit asas boleh menjadi atom, molekul atau ion. Oleh itu, kisi adalah struktur kristal dengan unit asas berulang ini.
Selain itu, jika rangkaian ini mengandungi ion yang disertai dengan ikatan ionik, kami memanggilnya sebagai kristal ionik. Sebagai contoh, natrium klorida adalah kisi ionik. Natrium adalah logam kumpulan 1, dengan itu membentuk kation +1 yang dikenakan sebagai kation yang paling stabil. Klorin adalah non -metal dan mempunyai keupayaan untuk membentuk anion caj a -1. Dalam kekisi, enam ion klorida mengelilingi setiap ion natrium dan sebaliknya. Kerana semua tarikan elektrostatik antara ion, struktur kekisi sangat stabil. Bilangan ion yang terdapat dalam kekisi berbeza dengan saiznya. Tenaga kekisi atau entalpi kekisi adalah ukuran kekuatan ikatan ionik dalam kekisi. Biasanya entalpi kekisi adalah eksotermik.
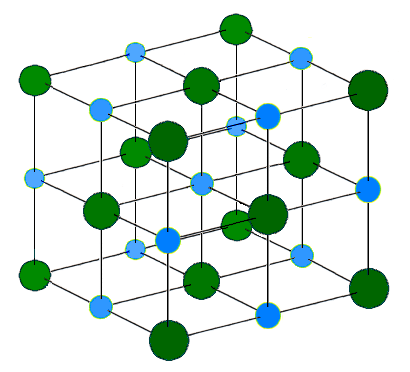
Rajah 02: Struktur kekisi natrium klorida
Berlian dan kuarza adalah dua contoh kisi kovalen tiga dimensi. Diamond terdiri daripada hanya atom karbon, dan setiap atom karbon kovalen mengikat ke empat atom karbon lain untuk membentuk struktur kisi. Oleh itu, setiap atom karbon mempunyai susunan tetrahedral. Diamond mempunyai kestabilan yang tinggi kerana struktur ini. (Diamond adalah salah satu mineral terkuat di bumi.) Kuarza atau silikon dioksida juga mempunyai ikatan kovalen, tetapi ikatan ini wujud antara atom silikon dan oksigen (kekisi atom yang berlainan). Kedua -dua kisi kovalen ini mempunyai titik lebur yang sangat tinggi, dan mereka tidak dapat menjalankan elektrik.
Apakah perbezaan antara molekul dan kekisi?
Molekul membentuk apabila dua atau lebih atom mengikat antara satu sama lain sama ada melalui ikatan kimia kovalen atau ikatan ionik. Sebaliknya, kekisi membentuk apabila sebilangan besar atom, molekul atau ikatan ion antara satu sama lain untuk membentuk struktur rangkaian biasa. Oleh itu, perbezaan utama antara molekul dan kisi adalah bahawa molekul mengandungi atom yang terikat antara satu sama lain manakala kisi mengandungi atom, molekul atau ion yang terikat antara satu sama lain.
Sebagai satu lagi perbezaan penting antara molekul dan kisi, kita boleh mengatakan bahawa molekul boleh berlaku sebagai pepejal, cecair atau gas manakala kisi hanya berlaku sebagai bahan pepejal. Selain itu, jisim molekul sangat rendah berbanding jisim kekisi kerana bilangan atom dalam kekisi adalah agak tinggi.
Lebih banyak perbezaan ditunjukkan di bawah dalam infographic perbezaan antara molekul dan kekisi.
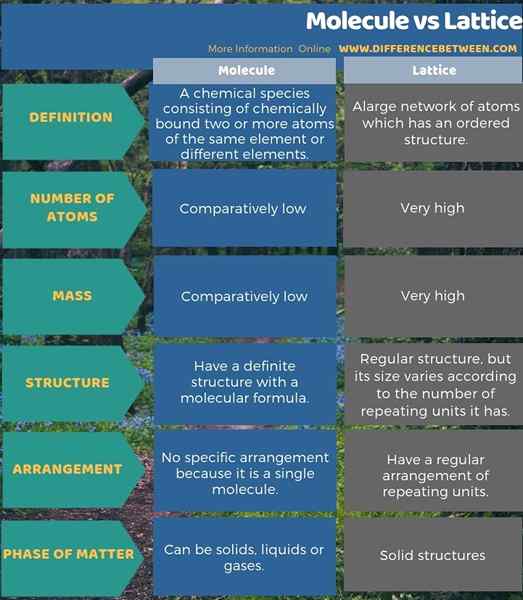
Ringkasan - molekul vs kekisi
Molekul dan kisi adalah dua istilah kimia penting dalam kimia. Mereka berbeza antara satu sama lain; Oleh itu kita tidak boleh menggunakannya secara bergantian. Perbezaan utama antara molekul dan kisi adalah bahawa molekul mengandungi atom yang terikat antara satu sama lain manakala kisi mengandungi atom, molekul atau ion yang terikat antara satu sama lain.
Rujukan:
1. Libretexts. "Struktur Ionik."Kimia Libreetexts, Yayasan Sains Kebangsaan, 19 Jun 2017. Terdapat di sini
2. Helmenstine, Anne Marie, PH.D. "Apa itu molekul?"Pemikiran, Jun. 11, 2018. Terdapat di sini
Ihsan gambar:
1."Molekul Air 3D" oleh DBC334 (versi pertama); Jynto (Versi Kedua)-Water-3D-VDW.PNG, (Domain Awam) melalui Commons Wikimedia
2."Sodium Chloride Crystal" oleh H padleckas (domain awam) melalui Commons Wikimedia


