Perbezaan antara tenaga elektronegativiti dan pengionan
The Perbezaan utama antara tenaga elektronegativiti dan pengionan ialah Elektronegativiti menerangkan tarikan elektron sementara tenaga pengionan merujuk kepada penyingkiran elektron dari atom.
Atom adalah blok bangunan semua bahan yang ada. Mereka sangat kecil sehingga kita tidak dapat memerhatikan mereka dengan mata kasar kita. Atom terdiri daripada nukleus, yang mempunyai proton dan neutron. Sebagai tambahan kepada neutron dan positron, terdapat zarah subatomik kecil lain dalam nukleus, dan terdapat elektron yang mengelilingi nukleus di orbital. Kerana kehadiran proton, nukleus atom mempunyai caj positif. Elektron di lingkungan luar mempunyai caj negatif. Oleh itu, daya menarik antara caj positif dan negatif atom mengekalkan strukturnya.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah elektronegativiti
3. Apakah tenaga pengionan
4. Perbandingan sampingan -elektua vs tenaga pengionan dalam bentuk jadual
5. Ringkasan
Apakah elektronegativiti?
Elektronegativiti adalah kecenderungan atom untuk menarik elektron dalam ikatan ke arah itu. Dengan kata lain, ini menunjukkan tarikan atom ke arah elektron. Kami biasanya menggunakan skala Pauling untuk menunjukkan elemen elemen.
Dalam jadual berkala, elektronegativiti berubah mengikut corak. Dari kiri ke kanan pada suatu tempoh, elektronegativiti meningkat, dan dari atas ke bawah pada kumpulan, elektronegativiti berkurangan. Oleh itu, fluorin adalah elemen paling elektronegatif dengan nilai 4.0 pada skala Pauling. Kumpulan satu dan dua elemen mempunyai kurang elektronegativiti; Oleh itu, mereka cenderung membentuk ion positif dengan memberi elektron. Oleh kerana kumpulan 5, 6, 7 elemen mempunyai nilai elektronegativiti yang lebih tinggi, mereka suka mengambil elektron dan dari ion negatif.
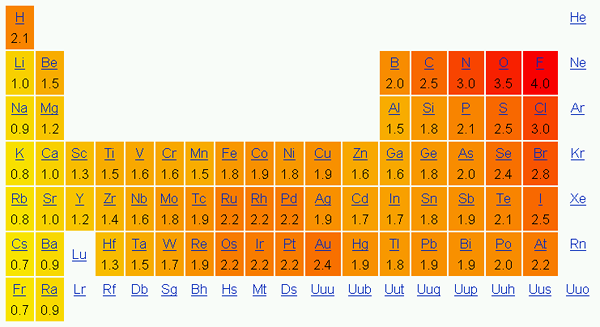
Rajah 01: Elektronegativiti mengikut skala Pauling
Elektronegativiti juga penting dalam menentukan sifat ikatan. Sekiranya kedua -dua atom dalam ikatan tidak mempunyai perbezaan elektronegativiti, maka ikatan kovalen tulen akan membentuk. Selain itu, jika perbezaan elektronegativiti antara kedua -duanya adalah tinggi, maka ikatan ionik akan menjadi hasilnya. Sekiranya terdapat sedikit perbezaan, ikatan kovalen kutub akan terbentuk.
Apakah tenaga pengionan?
Tenaga pengionan adalah tenaga yang harus diberikan kepada atom neutral untuk menghilangkan elektron daripadanya. Penyingkiran elektron bermaksud untuk membuangnya jarak tak terhingga dari spesies sehingga tidak ada daya tarikan antara elektron dan nukleus (penyingkiran lengkap).
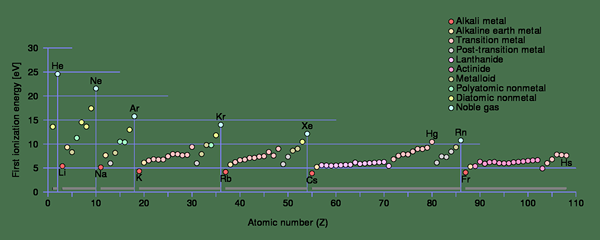
Kita boleh menamakan tenaga pengionan sebagai tenaga pengionan pertama, tenaga pengionan kedua dan sebagainya, bergantung kepada bilangan elektron yang dikeluarkan dari atom. Pada masa yang sama, ini akan menimbulkan kation dengan +1, +2, +3 caj, dan sebagainya.

Rajah 1: Trend tenaga pengionan untuk pengionan pertama dalam setiap tempoh jadual berkala
Dalam atom kecil, jejari atom kecil. Oleh itu, daya tarikan elektrostatik antara elektron dan neutron jauh lebih tinggi berbanding dengan atom dengan jejari atom yang lebih besar. Ia meningkatkan tenaga pengionan atom kecil. Sekiranya elektron lebih dekat dengan nukleus, tenaga pengionan akan lebih tinggi.
Selain itu, tenaga pengionan pertama atom yang berbeza juga berbeza. Sebagai contoh, tenaga pengionan pertama natrium (496 kJ/mol) jauh lebih rendah daripada tenaga pengionan pertama klorin (1256 kJ/mol). Ia adalah kerana dengan mengeluarkan satu elektron, natrium dapat memperoleh konfigurasi gas mulia; Oleh itu, ia dengan mudah menghilangkan elektron. Di samping itu, jarak atom kurang dalam natrium daripada klorin, yang menurunkan tenaga pengionan. Oleh itu, tenaga pengionan meningkat dari kiri ke kanan berturut -turut dan bawah ke atas dalam lajur jadual berkala (ini adalah kebalikan dari peningkatan saiz atom dalam jadual berkala). Semasa mengeluarkan elektron, terdapat beberapa contoh di mana atom mendapat konfigurasi elektron yang stabil. Pada ketika ini, tenaga pengionan cenderung melonjak ke nilai yang lebih tinggi.
Perbezaan antara tenaga elektronegativiti dan pengionan?
Elektronegativiti adalah kecenderungan atom untuk menarik elektron dalam ikatan ke arahnya sementara tenaga pengionan adalah tenaga atom neutral yang perlu mengeluarkan elektron daripadanya. Oleh itu, perbezaan utama antara tenaga elektronegativiti dan pengionan ialah elektronegativiti menerangkan tarikan elektron manakala tenaga pengionan merujuk kepada penyingkiran elektron dari atom.
Selain itu, terdapat satu lagi perbezaan yang signifikan antara tenaga elektronegativiti dan pengionan berdasarkan trend mereka dalam jadual berkala elemen. Elektronegativiti meningkat dari kiri ke kanan pada tempoh dan berkurangan ke atas pada kumpulan. Sedangkan, tenaga pengionan meningkat dari kiri ke kanan berturut -turut dan bawah ke atas dalam lajur jadual berkala. Walau bagaimanapun, kadang -kadang, atom mendapat konfigurasi elektron yang stabil, dan oleh itu, tenaga pengionan cenderung melompat ke nilai yang lebih tinggi.
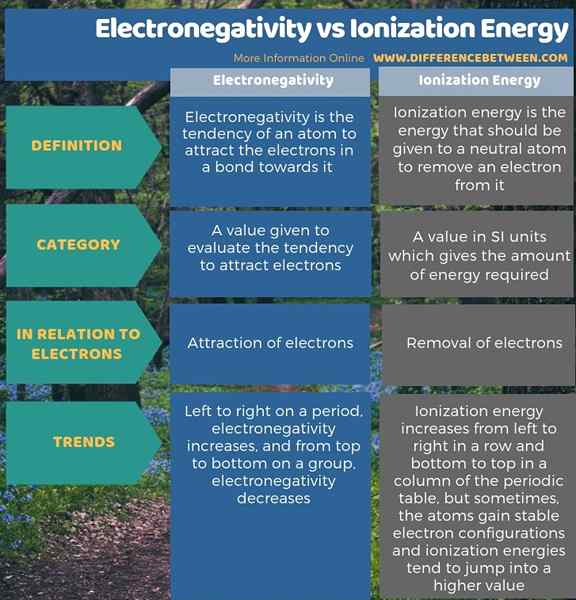
Ringkasan -Elektronegativiti vs tenaga pengionan
Istilah elektronegativiti dan tenaga pengionan menerangkan interaksi antara nukleus atom dan elektron. Perbezaan utama antara tenaga elektronegativiti dan pengionan ialah elektronegativiti menerangkan tarikan elektron manakala tenaga pengionan merujuk kepada penyingkiran elektron dari atom.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi dan contoh elektronegativiti."Thoughtco, Oct. 17, 2018, boleh didapati di sini.
2. Helmenstine, Anne Marie. "Definisi dan trend tenaga pengionan."Thoughtco, Jan. 24, 2019, boleh didapati di sini.
Ihsan gambar:
1. "Taula periòdica electronegativitat" oleh Joanjoc di Catalan Wikipedia - dipindahkan dari CA.Wikipedia ke Commons (Domain Awam) melalui Commons Wikimedia
2. "Tenaga Pengionan Pertama" oleh SPONK (Fail PNG) GLRX (SVG File) Wylve (ZH-HANS, ZH-Hant) Palosirkka (FI) Michel Djerzinski (VI) Tferenczy (CZ) , BS, SH) DEPIEP (Elemen 104-108) Bob Saint Clar (FR) Shizhao (ZH-Hans) Wiki Lic (es) Agung Karjono (ID).PNG oleh Sponk (CC oleh 3.0) melalui Commons Wikimedia


