Perbezaan antara konjugasi dan resonans

Conjugation vs Resonance
Konjugasi dan Resonans adalah dua fenomena penting dalam memahami tingkah laku molekul.
Apa itu konjugasi?
Dalam molekul apabila terdapat sel -bon tunggal dan berganda yang hadir, kita mengatakan bahawa sistem itu konjugasi. Contohnya, molekul benzena adalah sistem konjugasi. Dalam pelbagai ikatan, terdapat satu ikatan sigma dan satu atau dua kolam pi. Bon Pi dibuat dengan bertindih dengan orbital p. Elektron di orbital p terletak tegak lurus dengan satah molekul. Oleh itu, apabila terdapat ikatan PI dalam ikatan bergantian, semua elektron diselaraskan sepanjang sistem konjugasi. Dengan kata lain, kami menyebutnya awan elektron. Oleh kerana elektron diselaraskan, mereka tergolong dalam semua atom dalam sistem konjugasi, tetapi bukan hanya untuk satu atom. Ini mengurangkan tenaga keseluruhan sistem dan meningkatkan kestabilan. Bukan sahaja, ikatan Pi, tetapi juga pasangan elektron tunggal, radikal atau ion karbenium boleh mengambil bahagian dalam mewujudkan sistem konjugasi. Dalam keadaan ini, terdapat orbital P yang tidak terikat dengan dua elektron, satu elektron atau tiada elektron yang hadir. Terdapat sistem konjugasi linear dan siklik. Ada yang terhad kepada satu molekul sahaja. Apabila terdapat struktur polimer yang lebih besar, terdapat sistem konjugasi yang sangat besar. Kehadiran konjugasi membolehkan molekul bertindak sebagai kromofor. Chromophores boleh menyerap cahaya; Oleh itu, sebatian akan berwarna.
Apa itu resonans?
Semasa menulis struktur Lewis, kami hanya menunjukkan elektron valensi. Dengan mempunyai atom berkongsi atau memindahkan elektron, kami cuba memberi setiap atom konfigurasi elektronik gas mulia. Walau bagaimanapun, dalam percubaan ini, kita boleh mengenakan lokasi buatan di elektron. Akibatnya, lebih daripada satu struktur Lewis yang setara boleh ditulis untuk banyak molekul dan ion. Struktur yang ditulis dengan mengubah kedudukan elektron dikenali sebagai struktur resonans. Ini adalah struktur yang hanya wujud dalam teori. Struktur resonans menyatakan dua fakta mengenai struktur.
• Tiada struktur resonans akan menjadi perwakilan yang betul dari molekul sebenar. Dan tidak ada yang akan menyerupai sifat kimia dan fizikal molekul sebenar.
• Molekul sebenar atau ion akan diwakili oleh hibrid semua struktur resonans.
Struktur resonans ditunjukkan dengan anak panah ↔. Berikut adalah struktur resonans ion karbonat (CO32-).
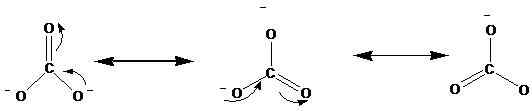
Kajian sinar-X telah menunjukkan bahawa molekul sebenar berada di antara resonans ini. Menurut kajian, semua ikatan karbon-oksigen berada dalam panjang yang sama dalam ion karbonat. Walau bagaimanapun, mengikut struktur di atas, kita dapat melihat satu ikatan berganda dan dua ikatan tunggal. Oleh itu, jika struktur resonans ini berlaku secara berasingan, idealnya harus ada panjang ikatan yang berbeza di ion. Panjang ikatan yang sama menunjukkan bahawa tidak ada struktur ini yang sebenarnya ada dalam alam semula jadi, melainkan hibrid ini wujud.
| Apakah perbezaan antara Konjugasi dan resonans? • Resonans dan konjugasi saling berkaitan. Sekiranya terdapat konjugasi dalam molekul, kita boleh menarik struktur resonans kepadanya dengan menggantikan ikatan PI. Oleh kerana elektron PI diselaraskan dalam keseluruhan sistem konjugasi, semua struktur resonans sah untuk molekul tersebut. • Resonans membolehkan sistem konjugasi untuk menghapuskan elektron. |


