Perbezaan antara sel tumpuan dan sel kimia
The Perbezaan utama antara sel konsentrasi dan sel kimia ialah, Dalam sel tumpuan, komposisi dua sel separuh adalah sama sedangkan, dalam sel kimia, komposisi mungkin atau mungkin tidak serupa.
Sel Konsentrasi adalah sejenis sel elektrokimia. Terdapat dua jenis sel elektrokimia atau sel kimia sebagai sel galvanik dan sel elektrolisis. Sel tumpuan adalah sejenis sel galvanik.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah sel tumpuan
3. Apa itu sel kimia
4. Perbandingan sampingan - Sel konsentrasi vs sel kimia dalam bentuk jadual
5. Ringkasan
Apakah sel tumpuan?
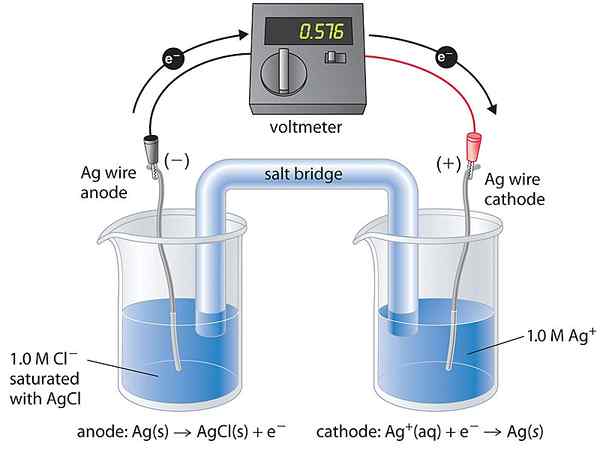
Sel Konsentrasi adalah sejenis sel galvanik di mana kedua -dua sel sel adalah serupa dalam komposisi. Oleh itu, kita mengatakan bahawa kedua -dua sel itu bersamaan. Mereka hanya berbeza dalam kepekatan. Voltan yang dihasilkan oleh sel ini sangat kecil kerana sel ini cenderung untuk mendapatkan keadaan keseimbangan. Keseimbangan datang apabila kepekatan dua sel separuh menjadi sama.

Sel tumpuan menghasilkan elektrik melalui pengurangan tenaga bebas termodinamik sistem. Oleh kerana komposisi sel separuh adalah serupa, tindak balas yang sama berlaku, tetapi dalam arah yang bertentangan. Oleh itu, proses ini meningkatkan kepekatan sel kepekatan yang lebih rendah dan mengurangkan kepekatan sel kepekatan yang lebih tinggi. Apabila aliran elektrik, tenaga haba dijana. Sel menyerap tenaga ini sebagai haba. Terdapat dua jenis sel tumpuan seperti berikut:
- Sel kepekatan elektrolit - Elektrod terdiri daripada bahan yang sama, dan separuh sel mengandungi elektrolit yang sama dengan kepekatan yang berbeza
- Sel kepekatan elektrod - Dua elektrod (bahan yang sama) dari kepekatan yang berbeza dicelupkan dalam elektrolit yang sama
Apa itu sel kimia
Sel kimia, lebih tepat sel elektrokimia, adalah sistem (peranti) yang dapat menghasilkan tenaga elektrik melalui tindak balas kimia spontan. Reaksi kimia yang terlibat dalam proses ini dipanggil reaksi redoks. Reaksi ini berlaku melalui pemindahan elektron antara spesies kimia. Selain itu, tindak balas redoks mempunyai dua reaksi separuh yang dikenali sebagai tindak balas pengoksidaan dan tindak balas pengurangan. Walaupun tindak balas pengoksidaan selalu melepaskan elektron ke sistem, tindak balas pengurangan mengambil elektron dari sistem. Oleh itu, kita boleh mengatakan bahawa kedua-dua reaksi separuh berlaku secara serentak.
Terdapat dua jenis sel elektrokimia sebagai sel voltan (galvanik) dan sel elektrolisis. Sel elektrokimia terdiri daripada dua sel separuh. Reaksi separuh berlaku di kedua-dua sel ini. Selain itu, tindak balas kimia yang berlaku di dalam sel menyebabkan pembentukan perbezaan berpotensi antara dua setengah sel.
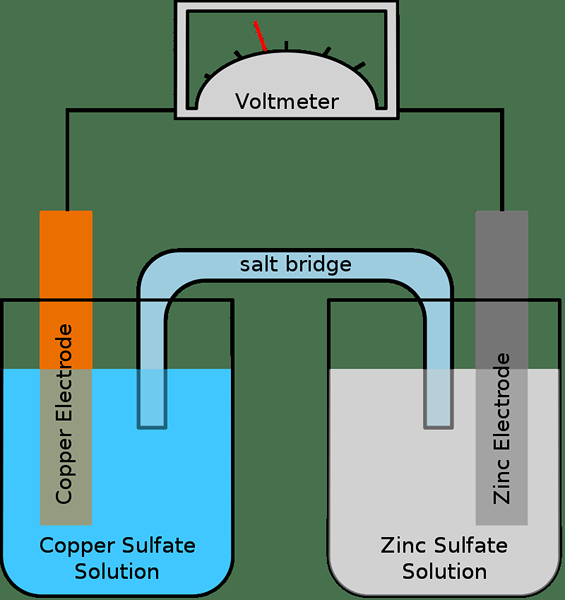
Rajah 01: Sel galvanik yang mudah
Sel separuh biasanya terdiri daripada elektrod dan elektrolit. Oleh itu, sel elektrokimia lengkap mempunyai dua elektrod dan dua elektrolit; Dua sel separuh kadang -kadang boleh menggunakan elektrolit yang sama. Sekiranya terdapat dua elektrolit yang berbeza, maka jambatan garam digunakan untuk mengekalkan hubungan antara elektrolit. Dan, ini dilakukan dengan membuat laluan untuk memindahkan ion melalui jambatan garam. Elektron mengalir dari setengah sel ke yang lain melalui litar luaran. Kami memanggil kedua -dua elektrod ini anod dan katod.
Selain itu, tindak balas pengoksidaan dan pengurangan berlaku dalam dua elektrod secara berasingan. Walaupun tindak balas pengoksidaan berlaku dalam anod, tindak balas pengurangan berlaku di katod. Oleh itu, elektron dihasilkan dalam anod dan mereka bergerak dari anod ke katod melalui litar luaran. Jambatan garam membantu mengekalkan sistem neutral (elektrik) dengan memindahkan ion melaluinya untuk mengimbangi caj elektrik.
Apakah perbezaan antara sel tumpuan dan sel kimia?
Sel Konsentrasi adalah sejenis sel elektrokimia. Terdapat dua jenis sel kimia; Mereka adalah sel galvanik dan sel elektrolisis. Sel tumpuan adalah sejenis sel galvanik. Perbezaan utama antara sel tumpuan dan sel kimia ialah dalam sel -sel kepekatan, komposisi dua sel separuh adalah sama sedangkan, dalam sel kimia, komposisi mungkin atau mungkin tidak serupa.
Berikut adalah ringkasan perbezaan antara sel tumpuan dan sel kimia.
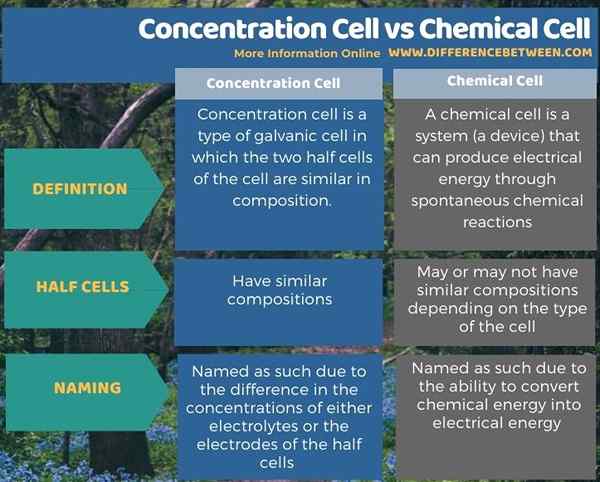
Ringkasan -Sel Konsentrasi vs Sel Kimia
Sel Konsentrasi adalah sejenis sel elektrokimia. Terdapat dua jenis sel kimia (elektrokimia) boleh sebagai sel galvanik dan sel elektrolisis. Untuk tepat, sel tumpuan adalah sejenis sel galvanik. Perbezaan utama antara sel tumpuan dan sel kimia ialah dalam sel -sel kepekatan komposisi dua sel separuh adalah sama sedangkan dalam sel kimia komposisi mungkin atau mungkin tidak serupa.
Rujukan:
1. Narendra Sriramula. "Sel Kimia."Slideshare.jaring. Terdapat di sini.
Ihsan gambar:
1. "Sel 3" oleh 473Shruthi V - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia
2. "Galvanic Cell" oleh Gringer - Fail: Galvanische Zelle.PNG, oleh Tinux (CC BY-SA 3.0) melalui Commons Wikimedia


