Perbezaan antara kromat dan dikromat

The Perbezaan utama antara kromat dan dikromat adalah kromat muncul dalam warna kuning cerah, sedangkan dikromat muncul dalam warna oren terang.
Kromat dan dikromat adalah anion yang mengandungi atom kromium dan oksigen. Oleh itu, mereka adalah pengoksidaan kromium. Kami sering menggunakan istilah ini sebagai istilah umum untuk menamakan sebatian yang mengandungi anion ini. Kedua -dua anion ini mempunyai struktur kimia yang hampir sama; kromat mempunyai satu anion kromat manakala dikromat mempunyai dua anion kromat dalam kombinasi antara satu sama lain. Tetapi mereka mempunyai penampilan yang berbeza.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Chromate
3. Apa itu dikromat
4. Perbandingan sampingan - Kromat vs dikromat dalam bentuk jadual
5. Ringkasan
Apa itu Chromate?
Kromat adalah pengoksidaan kromium yang mempunyai formula kimia cro42-. Umumnya, kami menggunakan istilah ini untuk menamakan sebatian yang mengandungi anion ini secara kolektif sebagai satu kumpulan, i.e. sebatian yang mengandungi anion kromat dinamakan sebagai kromat. Biasanya, kromat mempunyai warna kuning terang. Atom kromium dalam anion ini berada dalam keadaan pengoksidaan +6. Ia adalah ejen pengoksidaan yang agak kuat. Jisim molar anion ini adalah 115.99 g/mol.
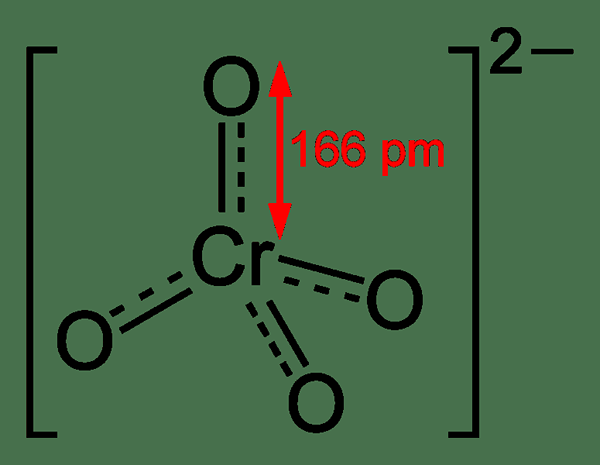
Rajah 01: Struktur kimia ion kromat
Apabila mempertimbangkan sifat dan tindak balas kromat, mereka boleh bertindak balas dengan hidrogen peroksida kerana anion peroksida menggantikan satu atau lebih atom oksigen. Dalam larutan berair, biasanya terdapat keseimbangan antara kromat dan dikromat. Walau bagaimanapun, kita dapat menemui jumlah kromat yang tinggi pada nilai pH yang tinggi (lebih tinggi daripada 6.5 pH) Di mana jumlah dikromat sangat kecil. Ini bermakna, dalam penyelesaian alkali, spesies utama adalah kromat.
Apa itu dikromat?
Dikromat adalah pengoksidaan kromium yang mempunyai formula kimia cr2O72-. Biasanya, kami menggunakan istilah ini untuk menamakan sebatian yang mengandungi anion ini secara kolektif sebagai satu kumpulan. Untuk e.g., kalium dikromat, natrium dikromat adalah dikromat. Tambahan pula, sebatian yang mengandungi dikromat sebagai anion menunjukkan warna oren terang. Jisim molar anion ini ialah 215.99 g/mol. Apabila mempertimbangkan geometri dikromat, ia mempunyai geometri tetrahedral di sekitar atom kromium.

Rajah 02: Penampilan sebatian dikromat
Dalam larutan berair, biasanya terdapat keseimbangan antara kromat dan dikromat. Walau bagaimanapun, kita dapat menemui jumlah dikromat dan jumlah kromat yang sangat kecil pada nilai pH yang rendah (lebih rendah daripada 6.5 ph).
Apakah perbezaan antara kromat dan dikromat?
Kromat dan dikromat adalah anion yang mengandungi atom kromium dan oksigen. Oleh itu, mereka adalah pengoksidaan kromium. Perbezaan utama antara kromat dan dikromat ialah kromat yang muncul dalam warna kuning cerah, sedangkan dikromat muncul dalam warna oren terang. Selain itu, ion kromat mempunyai satu atom kromium per anion manakala ion dikromat mempunyai dua atom kromium setiap anion.
Selain itu, perbezaan selanjutnya antara kromat dan dikromat adalah dalam jisim molar mereka. Jisim molar anion dichromate adalah 215.99 g/mol manakala jisim molar anion kromat adalah 115.99 g/mol. Dalam larutan berair, biasanya terdapat keseimbangan antara kromat dan dikromat. Walau bagaimanapun, kita dapat menemui jumlah kromat yang tinggi pada nilai pH yang tinggi (lebih tinggi daripada 6.5 pH) Di mana jumlah dikromat sangat kecil. Tetapi pada nilai pH yang rendah (lebih rendah daripada 6.5 pH), terdapat lebih banyak ion dikromat.

Ringkasan -Kromat vs dikromat
Kromat dan dikromat adalah anion yang mengandungi atom kromium dan oksigen. Oleh itu, mereka adalah pengoksidaan kromium. Perbezaan utama antara kromat dan dikromat ialah kromat yang muncul dalam warna kuning cerah manakala dikromat muncul dalam warna oren terang. Dalam larutan berair, biasanya terdapat keseimbangan antara kromat dan dikromat. Walau bagaimanapun, kita dapat menemui jumlah kromat yang tinggi pada nilai pH yang tinggi (lebih tinggi daripada 6.5 pH), manakala dalam nilai pH yang rendah (lebih rendah daripada 6.5 pH), terdapat lebih banyak ion dikromat.
Rujukan:
1."Dikromat."Pusat Kebangsaan Maklumat Bioteknologi. Pangkalan data kompaun pubchem, u.S. Perpustakaan Perubatan Negara, boleh didapati di sini.
2."Potassium dikromat."Wikipedia, Yayasan Wikimedia, 9 Nov. 2019, boleh didapati di sini.
3. Cheremisinoff, Paul N. "Rawatan contoh industri baja efluen."Pengurangan sisa dan pengurangan kos untuk industri proses, 1995, ms. 285-324., doi: 10.1016/B978-081551388-9.50010-5.
Ihsan gambar:
1. "Chromate-2d-Dimensions" oleh Ben Mills-Kerja Sendiri (Domain Awam) melalui Wikimedia Commons
2. "Potassium-Dichromate-Sample" oleh Benjah-Bmm27-Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


