Perbezaan antara persamaan seimbang dan persamaan ionik bersih

Perbezaan utama - Persamaan seimbang vs persamaan ionik bersih
Semua tindak balas kimia boleh ditulis sebagai persamaan. Komponen persamaan ini termasuk reaktan dengan keadaan fizikal mereka, anak panah untuk menunjukkan arah tindak balas dan produk reaksi dengan keadaan fizikal mereka. Sekiranya terdapat sebarang syarat khas yang digunakan, mereka juga ditulis secara ringkas pada anak panah. Sekiranya reaksi berada dalam keseimbangan, dua anak panah separuh digunakan dalam arah yang bertentangan. Persamaan kimia boleh ditulis dalam dua cara: sebagai persamaan seimbang atau sebagai persamaan ionik bersih. Perbezaan utama antara persamaan seimbang dan persamaan ionik bersih ialah Persamaan seimbang menunjukkan semua tindak balas yang berlaku dalam sistem bersama sedangkan Persamaan ionik bersih hanya menunjukkan tindak balas bersih yang berlaku selepas selesai reaksi tertentu.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah persamaan seimbang
3. Apakah persamaan ionik bersih
4. Perbandingan sampingan - Persamaan seimbang vs persamaan ionik bersih
5. Ringkasan
Apakah persamaan seimbang?
Reaksi kimia sangat penting dalam memahami tingkah laku sistem tertentu. Dengan menulis persamaan yang betul untuk tindak balas, seseorang dapat mendapatkan idea mengenai perubahan spesies yang berbeza dalam sistem itu. Untuk reaksi mudah seperti melarutkan NaCl di dalam air, persamaan dapat ditulis dengan mudah dengan meramalkan produk yang mungkin dari reaksi itu. Tetapi untuk reaksi kompleks yang lain, ujian selanjutnya mungkin perlu dijalankan untuk mengetahui produk sistem tertentu. Tetapi kebanyakan masa, persamaan bertulis sangat mungkin tidak seimbang, yang menjadikannya sukar untuk menjelaskan tingkah laku kimia sistem itu. Oleh itu, persamaan tidak seimbang juga harus seimbang. Persamaan seimbang merangkumi semua reaktan dan produk sistem itu. Persamaan ditulis dengan mempertimbangkan sebatian reaktan sebagai molekul. Sebagai contoh, persamaan seimbang antara ki dan pbno3 (jika mereka bertindak balas dalam air) akan menjadi;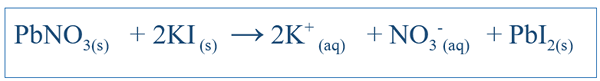
Kepentingan persamaan seimbang adalah bahawa ia mendedahkan jumlah reaktan yang harus ditambah memberikan butiran mengenai hubungan stoikiometri antara spesies dalam sistem. Dalam contoh di atas, nisbah antara pbno3 dan ki harus 1: 2 ketika menambahkan komponen tersebut ke dalam sistem.
Apakah persamaan ionik bersih?
Persamaan ionik bersih hanya menunjukkan tindak balas keseluruhan yang telah berlaku dalam sistem. Ia termasuk spesies ionik dan produk yang terbentuk. Tetapi ia tidak menunjukkan semua reaksi yang telah berlaku dalam sistem tertentu. Sebagai contoh, jika terdapat tindak balas antara dua molekul menggunakan air sebagai medium, sebatian mungkin dibubarkan di dalam air dan dipisahkan menjadi ion. Sebahagian daripada ion ini mungkin terlibat dalam tindak balas tetapi ada yang mungkin tidak. Kemudian persamaan ionik bersih hanya merangkumi ion yang mengambil bahagian dalam reaksi bersih. Ion lain, yang dipanggil ion penonton, dihapuskan dari persamaan untuk mendapatkan persamaan ionik bersih. Contohnya, jika ki dan pbno3 bertindak balas dalam air, tindak balas ionik bersih akan;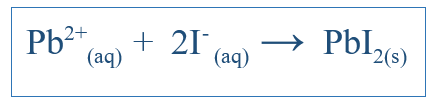
Ini juga termasuk k+ ion dan no3- ion, tetapi ion -ion tersebut hanya akan larut dan tidak mengambil bahagian dalam reaksi utama; Oleh itu, mereka tidak termasuk dalam reaksi ionik bersih.
Apakah perbezaan antara persamaan seimbang dan persamaan ionik bersih?
Persamaan seimbang vs persamaan ionik bersih | |
| Semua komponen yang digunakan ditulis sebagai reaktan dalam persamaan seimbang. | Reaktan yang hanya terlibat dalam tindak balas bersih akan ditulis dalam reaksi ionik bersih. |
| Produk | |
| Semua komponen pada akhir tindak balas dimasukkan dalam persamaan seimbang. | Dalam persamaan ionik bersih, hanya produk akhir bersih yang ditulis. |
| Perincian yang diberikan | |
| Persamaan seimbang akan memberi butiran mengenai semua spesies yang ada dalam sistem. | Persamaan ionik bersih hanya memberi butiran mengenai spesies yang mengambil bahagian dalam reaksi |
Ringkasan - Persamaan seimbang vs persamaan ionik bersih
Apabila sebatian ionik tertentu ditambah ke dalam air, mereka memecah dan membentuk ion yang dibubarkan di dalam air. Ini menghasilkan anion dan kation. Untuk menunjukkan spesies yang dihasilkan selepas selesai tindak balas dan arah reaksi, persamaan kimia boleh ditulis. Persamaan ini boleh seimbang memandangkan bilangan atom setiap spesies yang tinggal di kedua -dua belah anak panah; Kadang -kadang, walaupun pertuduhan spesies tersebut harus dipertimbangkan. Ini memberikan persamaan kimia yang seimbang untuk sistem tertentu. Walau bagaimanapun, persamaan ionik bersih hanya merangkumi spesies yang bertindak balas. Seperti yang dinyatakan sebelum ini, perbezaan utama antara persamaan seimbang dan persamaan ionik bersih adalah bahawa persamaan seimbang menunjukkan semua tindak balas dalam sistem manakala persamaan ionik bersih hanya menunjukkan tindak balas bersih yang berlaku pada selesai reaksi tertentu.
Rujukan:
1. Chang, r., 2010. Kimia. Edisi ke -10. NewYork: McGraw-Hill.
2. Tindak balas kimia. (n.d.). Diperoleh pada 26 Mei 2017, dari http: // www.Ric.edu/fakulti/ptiskus/reaksi/
3. Persamaan ionik dan ionik bersih lengkap. (n.d.). Diperoleh pada 26 Mei 2017, dari https: // www.Khanacademy.org/sains/kimia/reaksi-reaksi-stoikiom/jenis-of-chemical-reaksi/a/lengkap-ionic-and-net-ionic-equation.


