Perbezaan antara persamaan Arrhenius dan Eyring

The Perbezaan utama Antara persamaan Arrhenius dan Eyring ialah Persamaan Arrhenius adalah persamaan empirikal manakala persamaan eyring didasarkan pada justifikasi mekanikal statistik.
Persamaan Arrhenius dan persamaan eyring adalah dua persamaan penting dalam kimia fizikal. Apabila kita menganggap entalpi pengaktifan yang berterusan dan entropi pengaktifan yang berterusan, persamaan eyring adalah serupa dengan persamaan Arrhenius empirikal.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah persamaan Arrhenius
3. Apa itu persamaan eyring
4. Perbandingan sampingan - Arrhenius vs Eyring Persamaan dalam bentuk jadual
5. Ringkasan
Apakah persamaan Arrhenius?
Persamaan Arrhenius adalah formula kimia yang melibatkan kebergantungan suhu kadar tindak balas. Persamaan ini dicadangkan dan dibangunkan oleh saintis Svante Arrhenius pada tahun 1889. Persamaan Arrhenius mempunyai banyak aplikasi dalam menentukan kadar tindak balas kimia dan dalam pengiraan tenaga pengaktifan. Dalam konteks ini, persamaan Arrhenius memberikan justifikasi dan tafsiran fizikal untuk formula. Oleh itu, kita dapat mengenalinya sebagai hubungan empirikal. Persamaan Arrhenius dinyatakan seperti berikut:
K = ae(EA/RT)
Di mana k ialah pemalar kadar untuk campuran tindak balas, T adalah suhu mutlak sistem dalam kelvin, a adalah faktor pra-eksponen untuk tindak balas kimia, EA adalah tenaga pengaktifan untuk tindak balas dan r adalah pemalar gas sejagat. Dalam persamaan ini, apabila mempertimbangkan unit faktor pra-eksponen, a, ia sama dengan unit pemalar kadar yang bergantung kepada urutan reaksi. E.g. Sekiranya tindak balas adalah urutan pertama, maka unit A adalah sesaat (s-1). Dengan kata lain, dalam tindak balas ini, A adalah bilangan perlanggaran sesaat yang berlaku dalam orientasi yang betul. Selain itu, hubungan ini menerangkan bahawa meningkatkan suhu atau mengurangkan tenaga pengaktifan akan mengakibatkan peningkatan kadar tindak balas.

Rajah 01: Persamaan Arrhenius yang berbeza
Persamaan eyring apa?
Persamaan Eyring adalah persamaan yang menggambarkan perubahan kadar tindak balas kimia terhadap suhu campuran tindak balas. Persamaan ini dibangunkan oleh Henry Eyring pada tahun 1935 bersama dua saintis lain. Persamaan Eyring adalah serupa dengan persamaan Arrhenius apabila entalpi pengaktifan yang berterusan dan entropi pengaktifan yang berterusan dianggap. Formula umum untuk persamaan Eyring adalah seperti berikut:
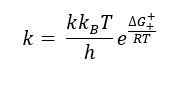
Di sini ΔG ‡ ialah tenaga pengaktifan Gibbs, κ adalah pekali penghantaran, kb adalah pemalar Boltzmann, dan H adalah pemalar Planck.
Apakah perbezaan antara persamaan Arrhenius dan Eyring?
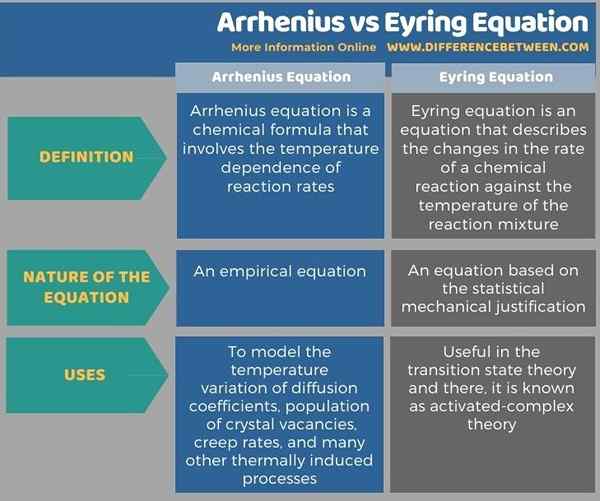
Persamaan Arrhenius dan Eyring adalah persamaan penting dalam kimia fizikal. Perbezaan utama antara arrhenius dan persamaan eyring ialah persamaan Arrhenius adalah persamaan empirikal manakala persamaan eyring didasarkan pada justifikasi mekanikal statistik. Selain itu, persamaan Arrhenius digunakan untuk memodelkan variasi suhu pekali penyebaran, populasi kekosongan kristal, kadar rayapan, dan banyak proses yang disebabkan oleh termal, sementara persamaan eyring berguna dalam teori keadaan peralihan dan di sana, ia dikenali sebagai diaktifkan -teori kompleks.
Di bawah infographic tabulasi perbezaan antara arrhenius dan persamaan eyring untuk perbandingan bersebelahan.
Ringkasan -Arrhenius vs Eyring Persamaan
Persamaan Arrhenius dan Eyring adalah persamaan penting dalam kimia fizikal. Perbezaan utama antara arrhenius dan persamaan eyring ialah persamaan Arrhenius adalah persamaan empirikal manakala persamaan eyring didasarkan pada justifikasi mekanikal statistik. Persamaan Arrhenius digunakan untuk memodelkan variasi suhu pekali penyebaran, populasi kekosongan kristal, kadar rayapan, dan banyak lagi proses yang disebabkan oleh termal. Persamaan Eyring, sebaliknya, berguna dalam teori keadaan peralihan, dan di sana, ia dikenali sebagai teori aktif-kompleks.
Rujukan:
1. "6.2.3.1: Persamaan Arrhenius."Kimia Libretexts, Libretexts, 11 Sept. 2020, boleh didapati di sini.
2. "Persamaan Eyring." Wikipedia, Yayasan Wikimedia, 16 Okt. 2020, boleh didapati di sini.
Ihsan gambar:
1. "ArrheniusMundim Baru" oleh Kleber Carlos Mundim - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


