Apakah perbezaan antara allosterisme positif dan negatif
The Perbezaan utama antara allosterisme positif dan negatif Adakah allosterisme positif dalam protein menunjukkan pertalian yang tinggi untuk ligan, sedangkan allosterisme negatif dalam protein menunjukkan pertalian yang rendah untuk ligan.
Allosterisme atau tingkah laku allosteric adalah fenomena di mana aktiviti protein dapat diubah bergantung kepada pengikatan beberapa molekul di tapak selain daripada tapak aktif protein (khususnya dalam enzim). Allosterisme positif menunjukkan bahawa pengikatan molekul effector ke enzim menyebabkan enzim mengubah konfigurasinya menjadi bentuk aktif. Sebaliknya, allosteirsm negatif menunjukkan bahawa pengikatan molekul effector menyebabkan enzim mengubah konfigurasinya dari bentuk aktif ke bentuk yang tidak aktif.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu allosterisme positif
3. Apa itu allosterisme negatif
4. Positif vs allosterisme negatif dalam bentuk jadual
5. Ringkasan -Allosterisme negatif positif
Apa itu allosterisme positif?
Allosterisme positif adalah perubahan dalam konfigurasi protein (kebanyakannya enzim) dari bentuk yang tidak aktif ke bentuk aktif apabila pengikatan molekul effector. Molekul effector mengikat dengan tapak selain daripada tapak aktif enzim; ia dipanggil tapak allosteric. Proses ini juga dikenali sebagai Pengaktifan Allosteric.
Contoh umum untuk mengikat molekul effector adalah ikatan molekul oksigen dengan molekul hemoglobin, yang mengaktifkan molekul hemoglobin untuk mengangkut oksigen dengan berkesan ke sel. Di sana, molekul oksigen mengikat dengan besi ferus molekul heme dalam molekul hemoglobin. Bentuk aktif dikenali sebagai oxy-hemoglobin, sementara bentuk tidak aktif dikenali sebagai deoxy-hemoglobin.
Apa itu allosterisme negatif?
Allosterisme negatif adalah perubahan dalam konfigurasi enzim dari bentuk aktif ke bentuk yang tidak aktif apabila pengikatan molekul effector. Molekul effector mengikat dengan tapak selain daripada tapak aktif enzim; ia dipanggil tapak allosteric. Proses ini juga dikenali sebagai perencatan allosteric.

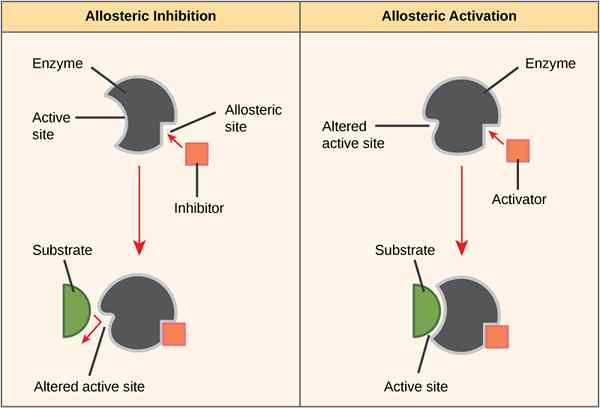
Rajah 01: Allosterisme positif dan negatif
Semasa allosterisme negatif, pengikatan satu ligan mengurangkan pertalian enzim untuk substrat di tapak aktif yang lain yang tersedia untuk mengikat substrat. Contohnya ialah mengikat 2,3-bpg ke tapak allosteric pada hemoglobin, yang menyebabkan penurunan dalam afiniti untuk oksigen semua subunit.
Apakah perbezaan antara allosterisme positif dan negatif?
Dalam allosterisme positif, pengikatan molekul effector ke enzim menyebabkan enzim mengubah konfigurasinya ke dalam bentuk aktif, sementara dalam allosteirsm negatif, pengikatan molekul effector menyebabkan enzim mengubah konfigurasi dari bentuk aktif ke bentuk yang aktif. Perbezaan utama antara allosterisme positif dan negatif ialah allosterisme positif dalam protein menunjukkan pertalian yang tinggi untuk ligan, sedangkan allosterisme negatif dalam protein menunjukkan pertalian yang rendah untuk ligan. Di samping itu, allosterisme positif melibatkan pengaktifan, sedangkan allosteirsm negatif melibatkan perencatan. Mengikat oksigen dengan hemoglobin adalah contoh allosterisme positif semasa mengikat 2,3-bpg dengan hemoglobin adalah contoh allosterisme negatif.
Infographic berikut membentangkan perbezaan antara allosterisme positif dan negatif dalam bentuk jadual untuk perbandingan sampingan.
Ringkasan -Allosterisme negatif positif
Dalam allosterisme atau tingkah laku allosteric, aktiviti protein boleh diubah bergantung kepada pengikatan beberapa molekul di tapak selain daripada tapak aktif protein (khususnya dalam enzim). Perbezaan utama antara allosterisme positif dan negatif ialah allosterisme positif dalam protein menunjukkan pertalian yang tinggi untuk ligan, sedangkan allosterisme negatif dalam protein menunjukkan pertalian yang rendah untuk ligan.
Rujukan:
1. "3.6: Interaksi allosteric." Kimia Libreetexts, Libretexts, 17 Julai 2020.
Ihsan gambar:
2. "Rajah 06 05 05 - Pengaktifan dan Pengaktifan Allosteric" oleh CNX OpenStax - (CC oleh 4.0) melalui Commons Wikimedia


