Apakah perbezaan antara undang-undang gay-lussac dan undang-undang avogadro
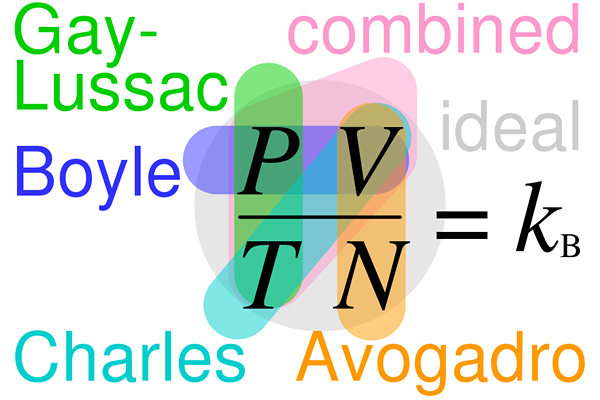
The Perbezaan utama antara undang-undang gay-lussac dan undang-undang avogadro adalah undang-undang gay-lussac menunjukkan bahawa jumlah gas berkadar terus dengan suhu gas, sedangkan undang-undang Avogadro menyatakan bahawa jumlah gas berkadar terus dengan bilangan molekul dalam gas.
Undang-undang gay-lussac menggambarkan pelbagai tekanan jisim tertentu gas secara langsung dengan suhu mutlak gas apabila jumlah tetap. Undang -undang Avogadro adalah undang -undang gas eksperimen yang menyatakan bahawa jumlah gas berkaitan dengan jumlah gas bahan yang ada dalam sampel tertentu.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu undang-undang gay-lussac
3. Apa itu undang -undang avogadro
4. Undang-undang Gay-Lussac Vs Avogadro dalam bentuk jadual
5. Ringkasan -Undang -undang Gay -Lussac Vs Avogadro
Apa itu undang-undang gay-lussac?
Undang-undang gay-lussac menggambarkan pelbagai tekanan jisim tertentu gas secara langsung dengan suhu mutlak gas apabila jumlah tetap. Kadang -kadang dinamakan undang -undang Amonton. Kita boleh memberikan ungkapan matematik untuk undang -undang ini seperti berikut:
P/t = k
Dalam persamaan ini, p merujuk kepada tekanan, t merujuk kepada suhu mutlak, dan k adalah malar. Kita boleh mengatakan bahawa ini adalah kes khas undang -undang gas ideal.
Derivatif undang-undang ini adalah undang-undang suhu tekanan, yang menggambarkan hubungan antara tekanan dan suhu jisim tertentu gas pada jumlah tetap.
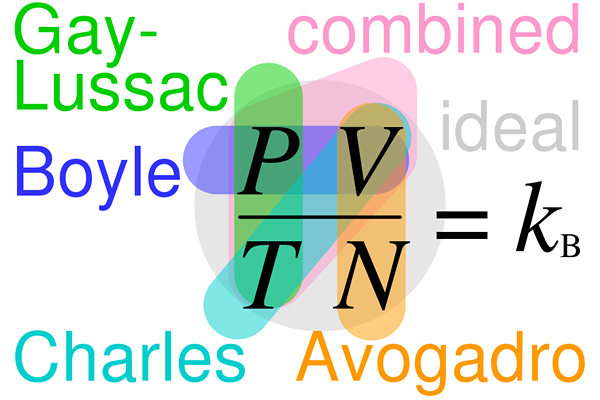
Mengikut undang -undang menggabungkan jumlah, gas bertindak balas antara satu sama lain dengan jumlahnya, dan mereka bertindak balas dalam nisbah bilangan keseluruhan yang mudah pada keadaan suhu dan tekanan yang malar. Dalam erti kata lain, nisbah antara jumlah gas reaktan dan produk gas dapat diberikan dalam jumlah keseluruhan yang mudah. Gay Lussac adalah salah seorang saintis pertama yang menemui hubungan ini, yang membawa kepada derivasi undang -undang Avogadro.
Apa itu undang -undang avogadro?
Undang -undang Avogadro adalah undang -undang gas eksperimen yang menyatakan bahawa jumlah gas berkaitan dengan jumlah gas bahan yang ada dalam sampel tertentu. Ia juga dinamakan Hipotesis Avogadro atau Prinsip Avogadro. Ini adalah bentuk undang -undang gas yang ideal. Undang -undang ini dinamakan sempena Amedeo Avogadro pada tahun 1812.
Menurut deskripsi moden, undang -undang Avogadro menyatakan bahawa jumlah yang sama dari semua gas yang berada dalam keadaan suhu dan tekanan yang sama mempunyai bilangan molekul yang sama. Sebagai contoh, jumlah gas hidrogen dan gas nitrogen yang sama terdiri daripada bilangan atom yang sama apabila kedua -dua gas ini berada dalam suhu dan tekanan yang sama. Secara praktikal, gas sebenar menunjukkan penyimpangan kecil dari tingkah laku gas yang ideal di mana undang -undang hanya memegang kira -kira tepat. Walau bagaimanapun, ia masih merupakan penghampiran penting bagi saintis. Secara matematik, undang -undang adalah seperti berikut:
V/n = k
Di mana v ialah jumlah gas, n adalah jumlah bahan gas dalam sampel, dan k adalah nilai malar yang diberikan untuk suhu dan tekanan tertentu.
Perbezaan antara undang-undang gay-lussac dan undang-undang avogadro
Undang-undang Gay-Lussac dan Undang-undang Avogadro adalah dua undang-undang gas penting. Perbezaan utama antara undang-undang gay-lussac dan undang-undang avogadro adalah bahawa undang-undang gay-lussac menunjukkan bahawa jumlah gas berkadar terus dengan suhu gas, sedangkan undang-undang Avogadro menyatakan bahawa jumlah gas berkadar terus dengan nombor tersebut molekul dalam gas.
Jadual berikut meringkaskan perbezaan antara undang-undang gay-lussac dan undang-undang avogadro.
Ringkasan -Undang -undang Gay -Lussac Vs Avogadro
Undang-undang Gay-Lussac dan Undang-undang Avogadro adalah dua undang-undang gas penting. Perbezaan utama antara undang-undang gay-lussac dan undang-undang avogadro adalah bahawa undang-undang gay-lussac menunjukkan bahawa jumlah gas berkadar terus dengan suhu gas, sedangkan undang-undang Avogadro menyatakan bahawa jumlah gas berkadar terus dengan nombor tersebut molekul dalam gas.
Rujukan:
1. "Undang -undang Gay -Lussac - Pernyataan, Formula, Penjelasan Terperinci." Byjus, 25 Mac. 2021.
Ihsan gambar:
1. "Hubungan Undang -undang Gas Ideal" oleh Cmglee - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


