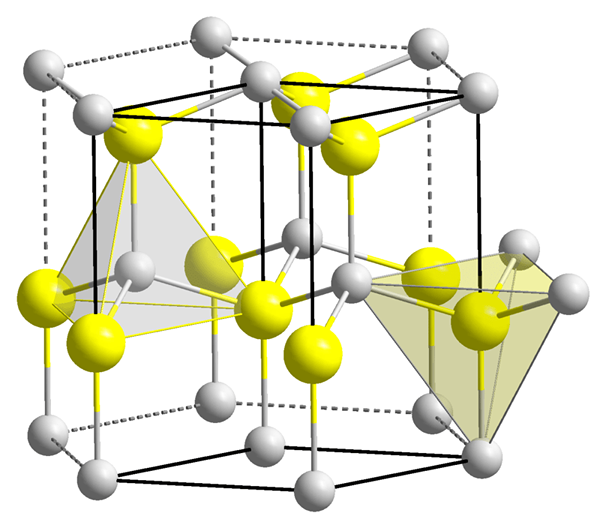
Perbezaan antara lompang tetrahedral dan octahedral
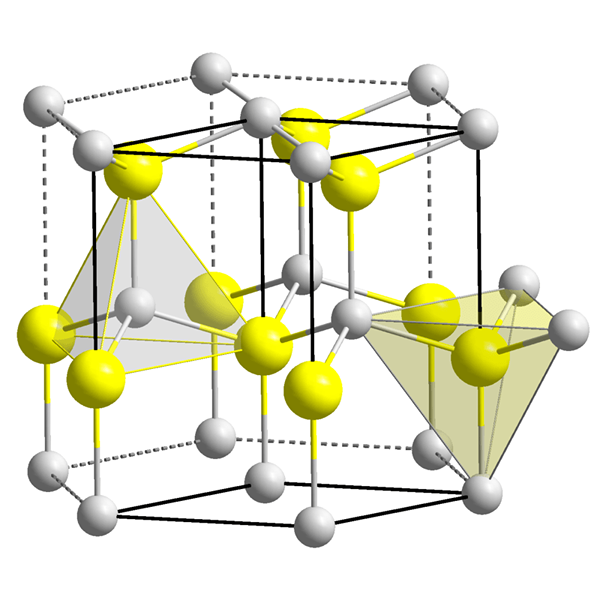
Perbezaan utama - Tetrahedral vs lompang octahedral
Semasa mempertimbangkan bahan -bahan tak organik yang dikemas dengan teliti, terdapat ruang kosong yang dikenali sebagai lompang. Lompang tidak didiami, ruang kosong sel unit dalam bahan tak organik. Sel unit adalah unit asas yang menunjukkan susunan kimia bahan keseluruhan yang terdiri daripada unit berulang. Atom, molekul atau ion yang sistem kristal terdiri daripada biasanya dikenali sebagai sfera. Dalam bahan -bahan pepejal yang rapat, terdapat dua jenis lompang yang dapat diperhatikan; lompang tetrahedral dan lompang octahedral. The Perbezaan utama antara tetrahedral dan octahedral void adalah bahawa lompang tetrahedral dapat dilihat dalam bahan yang mempunyai sistem kristal tetrahedral manakala lompang octahedral dapat dilihat dalam bahan yang mempunyai sistem kristal octahedral.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah lompang tetrahedral
3. Apakah lompang octahedral
4. Persamaan antara lompang tetrahedral dan octahedral
5. Perbandingan sampingan - Tetrahedral vs lompang octahedral dalam bentuk jadual
6. Ringkasan
Apakah lompang tetrahedral?
Lompang tetrahedral tidak didiami, ruang kosong hadir dalam bahan yang mempunyai sistem kristal tetrahedral. Oleh itu, kekosongan ini berlaku di antara empat konstituen. Kekosongan tetrahedral dibentuk apabila satu atom (atau sfera) diletakkan di bawah kemurungan yang dibentuk oleh tiga atom lain (atau sfera). Oleh itu, dua lapisan atom terlibat dalam pembentukan kekosongan tetrahedral.
Rajah 1: Dua lompang tetrahedral.
Walau bagaimanapun, bentuk tetrahedral kekosongan bukan tetrahedral, hanya susunan empat zarah di sekeliling kekosongan adalah tetrahedral. Bentuk lompang sangat rumit. Jumlah kekosongan tetrahedral jauh lebih kecil daripada atom (atau sfera) yang menyebabkan pembentukan kekosongan. Lebih besar saiz zarah di sekeliling kekosongan, lebih besar saiz kekosongan. Nombor koordinasi tetrahedral kekosongan adalah empat. Di sini, nombor koordinasi istilah bermaksud bilangan atom atau ion dengan segera mengelilingi kekosongan. Dalam sistem kristal, terdapat dua lompang setiap sfera (atom). Lompang -lompang dan saiz mereka mempunyai pengaruh yang besar terhadap sifat -sifat material.
Apakah lompang octahedral?
Lompang octahedral tidak didiami, ruang kosong yang terdapat dalam bahan yang mempunyai sistem kristal octahedral. Kekosongan octahedral dibentuk di antara enam atom (atau sfera). Di sana, tiga atom yang penuh sesak (atau sfera) membentuk segitiga sama dan diletakkan di atas tiga atom yang lain menyebabkan kekosongan membentuk. Di sini, juga dua lapisan atom terlibat dalam pembentukan kekosongan.
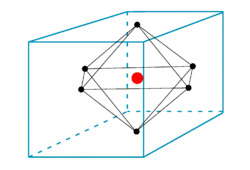
Rajah 2: Kekosongan octahedral di pusat sel unit.
Jumlah kekosongan octahedral sangat kecil jika dibandingkan dengan kekosongan tetrahedral. Apabila sel unit bahan (mempunyai susunan octahedral) dipertimbangkan, terdapat satu kekosongan octahedral di pusat sel unit, dan nombor koordinasi kekosongan ini adalah enam sejak enam atom mengelilinginya. Dalam kekisi kristal, ada satu kekosongan setiap satu sfera (atau atom).
Apakah persamaan antara lompang tetrahedral dan octahedral?
- Kedua -duanya adalah lompang yang terdapat dalam kisi kristal.
- Kedua -duanya lebih kecil daripada sfera yang membina kekisi kristal.
Apakah perbezaan antara lompang tetrahedral dan octahedral?
Tetrahedral void vs octahedral void | |
| Lompang tetrahedral tidak didiami, ruang kosong hadir dalam bahan yang mempunyai sistem kristal tetrahedral. | Lompang octahedral tidak didiami, ruang kosong yang terdapat dalam bahan yang mempunyai sistem kristal octahedral. |
| Sistem kristal | |
| Lompang tetrahedral boleh didapati dalam bahan yang mempunyai susunan tetrahedral dalam sistem kristal mereka. | Lompang octahedral boleh didapati dalam bahan yang mempunyai susunan octahedral dalam sistem kristal mereka. |
| Lokasi di sel unit | |
| Lompang tetrahedral dapat diperhatikan di tepi sel unit. | Lompang octahedral dapat diperhatikan di pusat sel unit. |
| Nombor koordinasi | |
| Nombor koordinasi tetrahedral kekosongan adalah empat. | Nombor koordinasi kekosongan octahedral adalah enam. |
| Bilangan lompang dalam kekisi kristal | |
| Terdapat dua lompang tetrahedral setiap sfera dalam kekisi kristal. | Terdapat satu kekosongan octahedral setiap sfera dalam kekisi kristal. |
Ringkasan - Tetrahedral vs lompang octahedral
Lompang adalah ruang kosong yang terdapat dalam sistem kristal yang timbul kerana pengaturan atom yang berbeza. Terdapat dua jenis lompang utama yang dinamakan sebagai Tetrahedral Void dan Octahedral Void. Perbezaan antara lompang tetrahedral dan octahedral adalah bahawa kekosongan tetrahedral dapat dilihat dalam bahan yang mempunyai sistem kristal tetrahedral manakala kekosongan octahedral dapat dilihat dalam bahan yang mempunyai sistem kristal octahedral.
Muat turun PDF Tetrahedral vs Octahedral Voltan
Anda boleh memuat turun versi PDF artikel ini dan menggunakannya untuk tujuan luar talian mengikut nota petikan. Sila muat turun versi pdf di sini perbezaan antara lompang tetrahedral dan octahedral
Rujukan:
1.Maramandansubu mengikuti. "Kekosan dalam kristal."LinkedIn Slideshare, 16 Jun 2013. Terdapat di sini
2."Tetrahedral Void dan Octahedral Void."Pengajian.com, 12 mar. 2016. Terdapat di sini
Ihsan imej;
1.'Wurtzite Polyhedra'by Solid State - Kerja Sendiri, (Domain Awam) melalui Commons Wikimedia
2.'Octahedral Crystal Field'by P.Wormer - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia