Perbezaan antara SP SP2 dan SP3
The Perbezaan utama antara sp sp2 dan sp3 ialah Orbital hibrid SP mempunyai ciri -ciri orbital 50% dan orbital hibrid SP2 mempunyai ciri orbit 33% manakala orbital hibrid SP3 mempunyai ciri orbit 25%.
Istilah SP, SP2 dan SP3, merujuk kepada hibridisasi orbital yang berbeza yang membawa kepada membentuk orbital hibrid. Orbital adalah kawasan hipotetikal di sekitar nukleus atom, yang mengandungi elektron atom itu. Orbital ini boleh menjalani hibridisasi untuk membentuk orbital hibrid baru yang boleh membentuk ikatan kimia kovalen. Terdapat beberapa bentuk hibridisasi mengikut orbital atom yang mengambil bahagian dalam proses hibridisasi. SP, SP2 dan SP3 adalah beberapa hibridisasi biasa yang melibatkan dalam orbital S dan P atom.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu sp
3. Apa itu SP2
4. Apa itu SP3
5. Perbandingan sampingan - SP vs SP2 vs SP3 dalam bentuk jadual
6. Ringkasan
Apa itu sp?
Hibridisasi SP adalah bentuk hibridisasi yang paling mudah di mana orbital s bertindih dengan orbital P untuk membentuk dua orbital SP baru. Cangkang elektron mengandungi tiga orbital p. Dalam hibridisasi ini, salah satu daripada tiga orbital P ini bercampur dengan orbital s atom yang sama. Oleh itu, terdapat dua orbital p yang tidak disengaja yang tinggal di atom-atom ini.

Rajah 01: Susunan spatial orbital hibrid SP
Nisbah pencampuran dua orbital atom adalah 1: 1 (s: p). Oleh itu orbital hibrid baru mempunyai 50% ciri orbital s dan 50% ciri -ciri orbital p. Ini pencampuran orbital atom S dan P membentuk dua orbital hibrid baru. Kedua -dua orbital ini mengatur dalam susunan ruang linear; mengarahkan setiap orbital atom ke arah yang bertentangan. Pengaturan ini mengakibatkan ketegangan paling sedikit antara kedua -dua orbital. Oleh itu, sudut ikatan akan menjadi 180◦.
Apa itu SP2?
Hibridisasi SP2 adalah satu bentuk hibridisasi orbit di mana satu orbital tumpukan dengan dua orbital P untuk membentuk tiga orbital hibrid baru. Oleh kerana terdapat tiga orbital atom p dalam atom, hibridisasi ini meninggalkan satu orbital p yang tidak hibrid. Tidak seperti dalam hibridisasi SP, dalam bentuk hibridisasi ini, ciri S setiap orbital hibrid SP2 adalah 33% hadir manakala ciri orbital p adalah 66%.
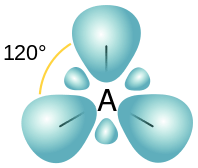
Rajah 02: Susunan spatial orbital SP2
Walau bagaimanapun, ini hanya kira -kira nilai kerana nisbah antara tiga orbital atom melibatkan dalam hibridisasi ini adalah S: p = 1: 2.
Maka ciri s sama dengan 100/3 = 33.33%
Dan ciri p sama dengan (100/3) x 2 = 66.66%
Ketiga orbital hibrid baru ini mendapat susunan ruang planar trigonal untuk meminimumkan ketegangan antara orbital. Juga, sudut ikatan antara orbital ini adalah 120◦.
Apa itu SP3?
Hibridisasi SP3 adalah satu bentuk hibridisasi orbit di mana satu orbital bertindih dengan tiga orbital P. Oleh itu, tidak ada orbital p yang tidak hibridasi kerana semua orbital P melibatkan dalam proses hibridisasi.

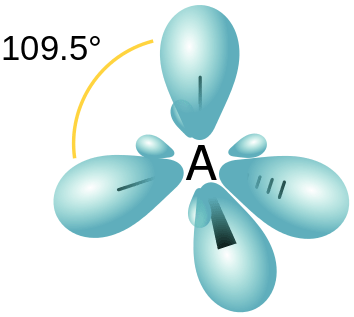
Rajah 03: Susunan spatial orbital hibrid SP3
Oleh itu, ini menghasilkan 4 orbital hibrid baru. Oleh kerana nisbah antara orbital S dan P adalah 1: 3, ciri s setiap orbital hibrid adalah 25% manakala ciri orbital p adalah 75%. Orbital hibrid baru ini mengatur dalam susunan tetrahedral dengan 109.5◦ Sudut ikatan.
Apakah perbezaan antara SP SP2 dan SP3?
Hibridisasi SP adalah bentuk hibridisasi yang paling mudah di mana orbital S yang bertindih dengan orbital P untuk membentuk dua orbital SP baru, dan hibridisasi SP2 adalah satu bentuk hibridisasi orbit sedangkan hibridisasi SP3 adalah bentuk hibridisasi orbit. Ini adalah perbezaan asas antara orbital hibrid sp sp2 dan sp3. Selain itu, setiap orbital hibrid baru yang terbentuk dalam ketiga -tiga bentuk hibridisasi mempunyai ciri -ciri orbital yang berbeza kerana orbital s bercampur dengan bilangan orbital yang berbeza. Oleh itu, mereka mempunyai ciri -ciri orbital yang berbeza.
Walau bagaimanapun, kita dapat menekankan perbezaan utama antara hibridisasi SP SP2 dan SP3 mengikut ciri -ciri S orbital hibrid ini; Orbital hibrid SP mempunyai ciri -ciri orbit 50%, dan orbital hibrid SP2 mempunyai ciri orbit 33% manakala orbital hibrid SP3 mempunyai ciri -ciri orbital 25%. Selain itu, setiap hibridisasi meninggalkan bilangan orbital yang tidak hibrid. Sebagai contoh, hibridisasi SP melibatkan hanya 1 P orbital atom. Oleh itu, ia meninggalkan dua orbital atom P yang tidak hibridasi.
Infographic di bawah menunjukkan perbandingan sampingan yang terperinci mengenai perbezaan antara hibridisasi SP SP2 dan SP3.

Ringkasan -SP SP2 vs SP3
Hibridisasi adalah proses di mana orbital atom bercampur dengan satu sama lain untuk membentuk orbital hibrid baru yang boleh menjalani ikatan kimia kovalen. Bentuk hibridisasi orbital atom yang paling mudah ialah hibridisasi SP, SP2 dan SP3. Perbezaan utama antara SP SP2 dan SP3 adalah bahawa orbital hibrid SP mempunyai ciri -ciri orbit 50% dan orbital hibrid SP2 mempunyai ciri orbit 33% manakala orbital hibrid SP3 mempunyai ciri -ciri orbital 25%.
Rujukan:
1. "Hibridisasi orbital."Wikipedia, Yayasan Wikimedia, 13 Sept. 2018. Terdapat di sini
2. Libretexts. "Hibridisasi."Kimia Libretexts, Libretexts, 21 Julai 2016. Terdapat di sini
Ihsan gambar:
1."AE2H" oleh JFMelero - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia
2."AE3H" oleh JFMelero - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia
3."AE4H" oleh JFMelero - Kerja Sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia


