Perbezaan antara elemen blok s dan p
Perbezaan utama -s vs. Elemen blok p
The Perbezaan utama Antara elemen blok S dan P dapat dijelaskan dengan baik menggunakan konfigurasi elektronik mereka. Dalam elemen blok S, elektron terakhir mengisi ke subshell S dan unsur blok p, elektron terakhir mengisi ke subshell p. Apabila mereka membentuk ion; elemen blok s Keluarkan elektron mereka dari subshell paling luar S dengan mudah manakala unsur blok P menerima elektron ke subshell P atau keluarkan elektron dari p-subshell. Sesetengah unsur dalam bentuk p-kumpulan positif membuang elektron dari p-subshell paling luar dan beberapa elemen (unsur-unsur paling elektronegatif) membentuk ion negatif yang menerima elektron dari orang lain. Apabila anda menganggap sifat kimia, terdapat perbezaan yang signifikan antara elemen blok S dan P; ini pada dasarnya disebabkan oleh konfigurasi elektron.
Apakah elemen s-blok?
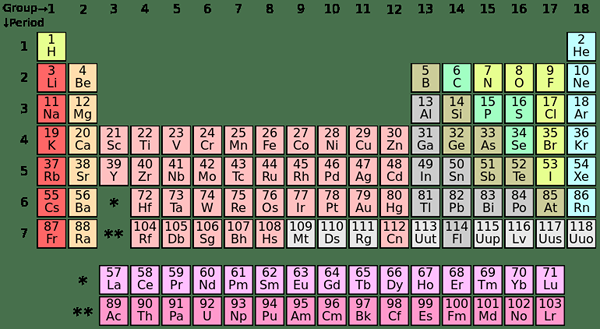
Unsur-unsur S-blok adalah elemen kimia dalam kumpulan I dan kumpulan II dalam jadual berkala. Oleh kerana S Subshell hanya dapat menampung dua elektron, unsur -unsur ini biasanya mempunyai satu (kumpulan I) atau dua (kumpulan II) elektron di dalam kerang terluar. Unsur -unsur dalam Kumpulan I dan II ditunjukkan di atas dalam jadual.
| IA | Ii a | |
| 2 | Li | Menjadi |
| 3 | Na | Mg |
| 4 | K | Ca |
| 5 | Rb | Sr |
| 6 | Cs | Ba |
| 7 | Fr | Ra |
| IA | Logam Alkali |
| Ii a | Logam Bumi Alkali |
Semua elemen dalam s-block membentuk ion positif dan mereka sangat reaktif.

Penempatan elemen s-blok dalam jadual berkala
Apakah elemen p-blok?
Unsur-unsur p-blok adalah unsur-unsur yang elektron terakhir diisi ke p subshell. Terdapat tiga p-orbital; Setiap orbital dapat menampung dua elektron, menjadikan jumlah enam p-elektron. Oleh itu, unsur-unsur p-blok mempunyai satu hingga enam p-elektron di cangkang terluar mereka. P-blok mengandungi kedua-dua logam dan bukan logam; Di samping itu terdapat beberapa metalloid juga.
| 13 | 14 | 15 | 16 | 17 | 18 | |
| 2 | B | C | N | O | F | Ne |
| 3 | Al | SI | P | S | Cl | Ar |
| 4 | Ga | Ge | Sebagai | Se | Br | Kr |
| 5 | Dalam | Sn | Sb | Te | I | Xe |
| 6 | Tl | Pb | Bi | PO | Pada | Rn |
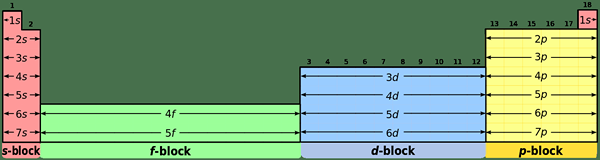
Apakah perbezaan antara elemen blok s dan p?
Konfigurasi elektron biasa:
S-blok elemen: Unsur-unsur S-blok mempunyai konfigurasi elektron biasa [gas mulia] ns1 (untuk elemen kumpulan saya) dan [gas mulia] ns2 (untuk elemen kumpulan II).
Elemen P-Blok: Unsur-unsur p-blok mempunyai konfigurasi elektron biasa [gas mulia] ns2 np1-6. Tetapi, helium mempunyai 1s2 konfigurasi; Ia adalah keadaan istimewa.
Keadaan pengoksidaan:
S-blok elemen: Unsur-unsur S-blok tidak menunjukkan pelbagai keadaan pengoksidaan seperti elemen p-blok. Sebagai contoh, elemen kumpulan I menunjukkan +1 unsur pengoksidaan dan kumpulan II menunjukkan +2 keadaan pengoksidaan.
Elemen P-Blok: Tidak seperti unsur-unsur S-menyekat, unsur-unsur p-blok mempunyai keadaan pengoksidaan yang sama untuk kumpulan masing-masing dalam jadual berkala dan beberapa keadaan pengoksidaan tambahan lain bergantung kepada kestabilan ion.
| Kumpulan | 13 | 14 | 15 | 16 | 17 | 18 |
| Konfigurasi elektron am | NS2np1 | NS2np2 | NS2np3 | NS2np4 | NS2np5 | NS2np6 |
| 1st ahli kumpulan | Menjadi | C | N | O | F | Dia |
| Nombor pengoksidaan biasa | +3 | +4 | +5 | -2 | -1 | 0 |
| Negara pengoksidaan lain | +1 | +2, -4 | +3, -3 | +4, +2, | +3, +5, +1, +7 | - |
Sifat:
S-blok elemen: Secara umum, semua elemen s-blok adalah logam. Mereka berkilat, konduktor elektrik dan haba yang baik dan mudah dikeluarkan elektron dari shell valence. Mereka adalah elemen paling reaktif dalam jadual berkala.
Elemen P-Blok: Sebilangan besar elemen p-blok bukan logam. Mereka mempunyai titik mendidih yang rendah, konduktor yang lemah dan sukar untuk mengeluarkan elektron dari kulit paling luar. Sebaliknya, mereka mendapat elektron. Sebahagian daripada bukan logam adalah pepejal (c, p, s, se) pada suhu bilik manakala beberapa gas (oksigen, nitrogen). Bromin adalah bukan logam, dan ia adalah cecair pada suhu bilik.
Di samping itu, p-blok mengandungi beberapa elemen logam; Aluminium (Al), Gallium (Ga), Indium (IN), Tin (Sn), Thallium (TL), Lead (Pb), dan Bismuth (Bi).
Ihsan gambar:
1. "Jadual Berkala (Polatomik)" oleh Depiep [CC BY-SA 3.0] melalui Commons
2. "Blok jadual berkala SPDF (32 lajur)" oleh Pengguna: DEPIEP [CC BY-SA 3.0] melalui Commons