Perbezaan antara reaksi redoks dan nonredoks

The Perbezaan utama antara reaksi redoks dan nonredoks ialah Dalam tindak balas redoks, keadaan pengoksidaan beberapa unsur kimia berubah dari satu negeri ke keadaan lain sedangkan, dalam tindak balas nonredoks, keadaan pengoksidaan unsur -unsur kimia tidak berubah.
Reaksi redoks dan nonredoks adalah dua jenis tindak balas kimia utama. Kedua -dua kumpulan ini berbeza antara satu sama lain bergantung kepada perubahan yang berlaku kepada keadaan pengoksidaan unsur -unsur kimia yang mana reaktan dibuat.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah reaksi redoks
3. Apakah reaksi nonredoks
4. Perbandingan sampingan - reaksi redoks vs nonredoks dalam bentuk jadual
5. Ringkasan
Apakah reaksi redoks?
Reaksi redoks adalah jenis tindak balas kimia di mana pengoksidaan dan pengurangan separuh reaksi berlaku secara serentak. Dalam tindak balas ini, kita menganggap pengoksidaan dan pengurangan sebagai proses pelengkap. Di sini, pengoksidaan adalah kehilangan elektron atau peningkatan keadaan pengoksidaan sementara pengurangan adalah keuntungan elektron atau penurunan keadaan pengoksidaan. Istilah "redoks" adalah bentuk pendek dari proses pengurangan pengoksidaan.
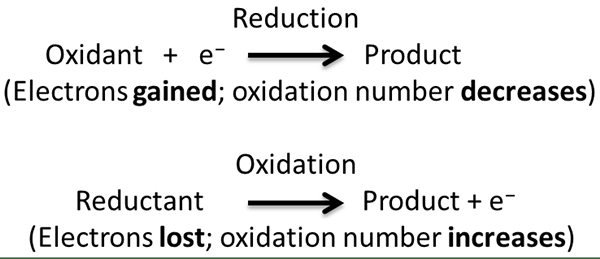
Semasa tindak balas redoks, sebatian kimia/reaktan yang mengalami pengurangan dipanggil ejen pengoksidaan sementara sebatian yang sedang menjalani pengoksidaan dipanggil ejen pengurangan. Ini kerana ejen pengoksidaan menyebabkan sebatian lain menjalani pengoksidaan dan sebaliknya.
Dalam reaksi redoks, apa yang sebenarnya berlaku ialah pemindahan elektron antara dua reaktan melalui separuh tindak balas. Kita dapat dengan mudah mengenal pasti pemindahan elektron ini melalui memerhatikan keadaan pengoksidaan unsur -unsur kimia. Semasa pemindahan elektron, keadaan pengoksidaan meningkat jika elektron hilang kerana ia meninggalkan proton tidak seimbang dalam atom, dan keadaan pengoksidaan berkurangan apabila elektron diperolehi kerana elektron adalah caj negatif zarah subatomik. Terdapat pelbagai jenis tindak balas redoks, seperti tindak balas penguraian, tindak balas gabungan, tindak balas anjakan, dan tindak balas tidak seimbang.
Apakah reaksi nonredoks?
Reaksi nnonredoks adalah tindak balas kimia di mana tiada perubahan dalam keadaan pengoksidaan unsur kimia berlaku. Oleh itu, tindak balas kimia ini tidak mempunyai reaksi separuh untuk pengoksidaan dan pengurangan seperti dalam reaksi redoks. Dengan kata lain, terdapat pemindahan elektron yang berlaku semasa perkembangan tindak balas kimia.

Rajah 02: tindak balas peneutralan NaOH dan HCl
Contoh biasa tindak balas bukan redoks termasuk tindak balas peneutralan dan tindak balas anjakan berganda.
Apakah perbezaan antara reaksi redoks dan nonredoks?
Reaksi redoks dan nonredoks adalah dua jenis tindak balas kimia. Perbezaan utama antara reaksi redoks dan nonredoks ialah dalam tindak balas redoks, keadaan pengoksidaan beberapa unsur kimia berubah dari satu keadaan ke keadaan lain sedangkan, dalam reaksi nonredoks, keadaan pengoksidaan unsur -unsur kimia tidak berubah. Selain itu, reaksi redoks mempunyai pengoksidaan separuh reaksi dan pengurangan separuh tindak balas sementara tiada reaksi separuh tertentu dapat dilihat dalam reaksi nonredoks. Reaksi penguraian, tindak balas anjakan, tindak balas tidak seimbang, dll. adalah contoh tindak balas redoks semasa tindak balas peneutralan, reaksi anjakan berganda, dll. adalah contoh tindak balas nonredoks.
Infographic berikut menyusun perbezaan antara reaksi redoks dan nonredoks.

Ringkasan -Reaksi Redox vs Nonredox
Reaksi redoks dan nonredoks adalah dua jenis tindak balas kimia. Perbezaan utama antara reaksi redoks dan nonredoks ialah dalam tindak balas redoks, keadaan pengoksidaan beberapa unsur kimia berubah dari satu keadaan ke keadaan lain sedangkan, dalam reaksi nonredoks, keadaan pengoksidaan unsur -unsur kimia tidak berubah.
Rujukan:
1. "Reaksi pengurangan pengoksidaan." Kimia Libreetexts, Libretexts, 15 Ogos. 2020, boleh didapati di sini.
Ihsan gambar:
1. "Redox Halves" oleh Cameron Garnham - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia
2. "Reaksi peneutralan antara natrium hidroksida dan asid hidroklorik" oleh bluescan sv.Wiki - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia


