Perbezaan antara protium dan deuterium

The Perbezaan utama antara protium dan deuterium ialah Protium tidak mempunyai neutron dalam nukleus atomnya, sedangkan deuterium mempunyai satu neutron.
Protium dan deuterium adalah isotop hidrogen. Oleh itu, mereka berbeza antara satu sama lain mengikut bilangan neutron yang terdapat dalam nukleus atom mereka. Hidrogen mengandungi satu proton dalam nukleus atom: oleh itu, bilangan atom hidrogen adalah 1. Terdapat tiga isotop hidrogen. Ketiga isotop juga mengandungi satu proton. Kita boleh menunjukkan tiga isotop sebagai 1H, 2H dan 3H. Nilai -nilai dalam superskrip adalah jisim atom unsur -unsur ini.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Protium
3. Apa itu deuterium
4. Perbandingan sampingan - Protium vs deuterium dalam bentuk jadual
5. Ringkasan
Apa itu Protium?
Protium adalah isotop hidrogen yang mengandungi satu proton dan satu elektron. Ia tidak mempunyai neutron dalam nukleus atom. Oleh itu, hanya ada satu proton dalam nukleus. Isotop ini dinamakan demikian kerana kehadiran proton tunggal ini. Kita boleh menunjukkan adalah seperti 1H atau hidrogen-1, di mana 1 adalah jisim atom protium.

Protium adalah isotop hidrogen yang paling biasa dan berlimpah. Kelimpahannya adalah kira -kira 99%. Ini dianggap sebagai isotop yang stabil kerana proton dalam atom ini tidak pernah diperhatikan mengalami kerosakan. Walau bagaimanapun, menurut teori, ia mengalami kerosakan dengan separuh hayat yang sangat besar, sehingga tidak dapat dilihat.
Apa itu deuterium?
Deuterium adalah isotop hidrogen yang mempunyai proton, neutron dan elektron. Tidak seperti Protium, isotop ini mempunyai proton dan neutron bersama dalam nukleus atom. Oleh itu, jisim atom isotop ini adalah 2. Kemudian kita boleh menamakannya sebagai hidrogen-2 atau 2H. Deuterium juga merupakan isotop stabil hidrogen. Walau bagaimanapun, ia tidak banyak berbanding protium. Kelimpahan berbeza antara 0.0026-0.0184%. Tidak seperti tritium, deuterium tidak radioaktif. Ia juga tidak menunjukkan ketoksikan.
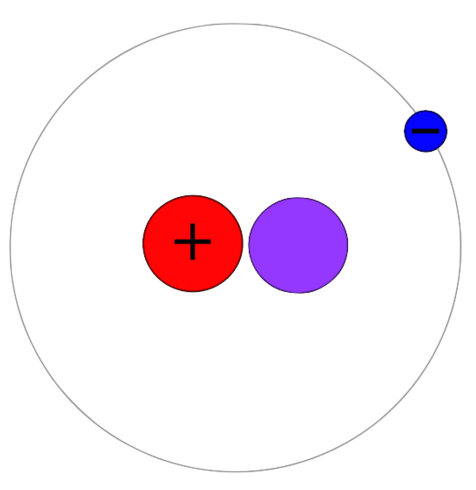
Air biasanya mengandungi hidrogen-1 yang digabungkan dengan atom oksigen. Tetapi boleh ada hidrogen-2 yang digabungkan dengan oksigen, yang membentuk air. Ia adalah air berat. Formula kimia untuk air berat adalah d2O di mana d adalah deuterium dan o adalah oksigen. Selain itu, kita boleh menggunakan deuterium dan sebatiannya dalam eksperimen kimia. Sebagai contoh, mereka berguna sebagai label bukan radioaktif dalam eksperimen seperti pelarut yang digunakan dalam spektroskopi NMR. Selain itu, kita boleh menggunakan air berat sebagai moderator neutron dan penyejuk untuk reaktor nuklear. Deuterium juga merupakan bahan bakar untuk pembelahan nuklear yang dijalankan dalam skala komersial.
Apakah perbezaan antara Protium dan Deuterium?
Terdapat tiga isotop hidrogen: protium, deuterium dan tritium. Perbezaan utama antara protium dan deuterium ialah protium tidak mempunyai neutron dalam nukleus atomnya, sedangkan deuterium mempunyai satu neutron. Oleh itu, ketiga -tiga isotop berbeza antara satu sama lain mengikut bilangan neutron yang terdapat dalam nukleus atom mereka. Juga, disebabkan oleh sebab ini, jisim atom protium adalah 1 manakala jisim atom deuterium adalah 2.
Selain itu, kita boleh menunjukkan isotop protium sebagai hidrogen-1 atau 1H dan isotop deuterium sama ada hidrogen-2 atau 2H. Protium adalah isotop hidrogen yang paling banyak, dan kelimpahannya adalah kira -kira 99%; Deuterium agak kurang banyak (kira -kira 0.002%). Walau bagaimanapun, ia juga stabil sebagai protium.
Di bawah infographic meringkaskan perbezaan antara Protium dan Deuterium.

Ringkasan -Protium vs deuterium
Terdapat tiga isotop hidrogen: protium, deuterium dan tritium. Ketiga isotop ini berbeza antara satu sama lain bergantung kepada jisim atom, iaitu bilangan proton dan neutron dalam nukleus atom. Perbezaan utama antara protium dan deuterium ialah protium tidak mempunyai neutron dalam nukleus atomnya, sedangkan deuterium mempunyai satu neutron.
Rujukan:
1. Helmenstine, Anne Marie. "Adakah deuterium radioaktif?"Thoughtco, Mei. 20, 2019, boleh didapati di sini.
Ihsan gambar:
1. "Hidrogen" oleh Mets501 - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia
2. "H -2 Atom" oleh Zyjacklin - Kerja Sendiri (CC0) melalui Commons Wikimedia


