Perbezaan antara sel primer dan menengah
Perbezaan utama - Sel utama dan menengah
Bateri digunakan semasa penyimpanan kuasa elektrik diperlukan. Mereka mengumpulkan dan memberikan caj elektrik sebagai arus elektrik apabila diperlukan. Bateri terdiri daripada sel utama atau menengah. The Perbezaan utama antara sel primer dan menengah adalah kebolehgunaan semula. Sel sekunder boleh digunakan semula dan lagi sementara sel -sel utama hanya boleh digunakan sekali. Tujuan dan beban yang disambungkan ke bateri bergantung pada jenis sel di dalamnya. Mungkin terdapat satu atau lebih sel jenis tunggal dalam bateri; Jadi yang menentukan voltan, atau dengan kata lain, daya elektromotif (EMF) bateri itu. Mana -mana sel terdiri daripada 3 bahagian utama; iaitu, anod, katod, dan elektrolit.
Apa sel utama?
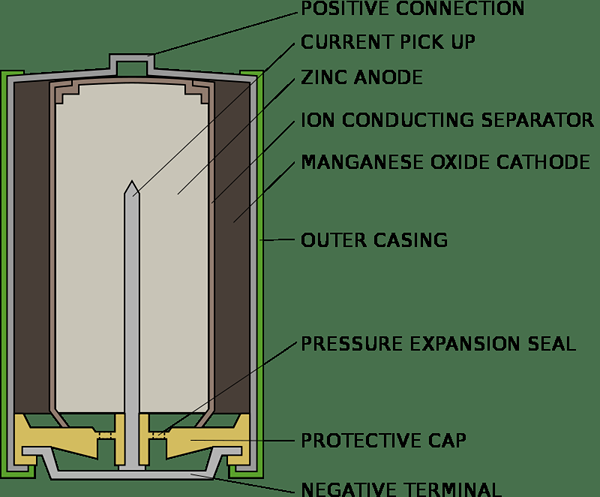
Sel utama boleh digunakan sekali dan dibuang. Mereka tidak boleh dicas semula dan digunakan semula. Label sel utama selalu menyatakan bahawa ia tidak boleh dicas semula kerana ia berbahaya untuk mencuba cas semula dan mungkin meletup, jika berbuat demikian. Sel kering dan sel merkuri adalah contoh untuk sel utama. Sel utama pada dasarnya adalah sel kimia dan menghasilkan arus elektrik dengan tindak balas kimia yang tidak dapat dipulihkan. Setelah reaksi dilakukan, ia tidak dapat ditubuhkan semula. Untuk seketika, sel kering terdiri daripada katod karbon yang dikelilingi oleh NH4CL dalam bekas Zink. Tampalan NH4CL dan ZnCl2 berfungsi sebagai elektrolit manakala bekas zink bertindak sebagai anod. Sebilangan kecil MNO2 juga dicampur dengan elektrolit. Proses kimia sel kering dapat diringkaskan seperti berikut;
Zn-> zn2++2 elektron (reaksi anod)
NH4+ + Mno2 + elektron -> MNO (OH) + NH3 (Reaksi Katod)
Sel utama biasanya dijumpai dan digunakan dalam kebanyakan mainan elektrik, jam, jam tangan pergelangan tangan dan pengawal jarak jauh domestik.

Apa sel sekunder?
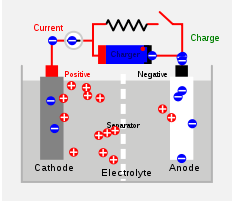
Sel sekunder juga sel kimia tetapi, boleh dicas semula untuk digunakan lagi. Reaksi kimia yang menghasilkan elektrik boleh diterbalikkan, dan sel boleh digunakan sebagai yang baru selepas proses pengisian. Sel boleh digunakan semula tetapi seumur hidup dipendekkan. Sel-asid dan sel hidup adalah beberapa contoh sel sekunder. Didalam Sel asid plumbum, Lead Acts sebagai anod dan grid plumbum yang dibungkus dengan plumbum dioksida bertindak sebagai katod. Asid sulfurik diisi untuk berfungsi sebagai elektrolit. Reaksi kimia di dalam sel asid plumbum diberikan di bawah. Mereka adalah proses yang boleh diterbalikkan.
PB+SO42- --> PBSO4 + 2 elektron (reaksi anod)
Pbo2 + 4H+ + Jadi42- + 2 Elektron -> PBSO4 + 2h2O (reaksi katod)
Kenderaan hibrid moden dikuasakan oleh petroleum dan kuasa elektrik. Caj bateri semasa kereta bergerak, dan kemudian kuasa elektrik yang disimpan boleh digunakan untuk dijalankan. Semua pek bateri di dalam kereta tersebut diperbuat daripada sel sekunder. Satu lagi penggunaan biasa untuk bateri sekunder adalah untuk memulakan, pencahayaan, dan pencucuhan dalam kenderaan. Juga, ia digunakan dalam bekalan kuasa yang tidak terganggu (UPSS), telekomunikasi, dan alat mudah alih.
Apakah perbezaan antara sel primer dan menengah?
Keberkesanan kos:
Menggunakan Sel utama kos efektif berbanding sel sekunder, pada mulanya.
Tetapi menggunakan sel sekunder akan menjadi pelaburan jangka panjang kerana sel -sel utama akan digantikan dengan set lain selepas beberapa waktu.
Kadar Pelanggaran Sendiri:
Sel utama mempunyai kadar pelepasan diri yang lebih rendah oleh itu mereka sesuai untuk peranti berfungsi siap sedia yang memerlukan arus kecil secara berterusan untuk masa yang lama. Ini adalah fakta penting bagi pihak peralatan keselamatan seperti pengesan asap/ kebakaran, penggera pencuri dan jam.
Sel sekunder mempunyai pelepasan diri yang lebih tinggi.
Kos dan penggunaan:
Sel utama murah dan senang digunakan.
Sel sekunder mahal dan lebih kompleks dalam penggunaan.
Ihsan gambar:
1. "Alkali-battery-English" oleh Tympanus [Domain Awam] melalui Commons
2. Rajah sel sekunder oleh pengarang asal: Barrie Lawson. [CC BY-SA 3.0], melalui Wikimedia Commons


