Perbezaan antara kalium klorida dan kalium glukonat

Kalium klorida vs kalium glukonat
Potassium adalah salah satu elektrolit penting dalam badan. Penting untuk mengekalkan pH dan tekanan darah yang betul. Juga, penting untuk transduksi isyarat yang berkesan. Oleh itu, jika kalium kurang dalam badan, ia harus diambil dari luar. Potassium Chloride dan Potassium Gluconate adalah dua sebatian, yang diberikan sebagai suplemen untuk merawat kekurangan kalium.
Kalium klorida
Potassium Chloride, yang ditunjukkan sebagai KCl, adalah pepejal ionik. Ia dalam bentuk warna putih, kristal tidak berbau. Potassium adalah logam kumpulan 1; dengan itu membentuk kation +1 yang dikenakan. Konfigurasi elektronnya ialah 1s2 2s2 2p6 3s2 3p6 4s1. Ia boleh melepaskan satu elektron, yang berada di 4s sub orbital dan menghasilkan +1 kation. Elektronegativiti kalium sangat rendah, membolehkannya membentuk kation dengan mendermakan elektron ke atom elektronegatif yang lebih tinggi (seperti halogen). Oleh itu, kalium sering membuat sebatian ionik.
Klorin adalah non -metal dan mempunyai keupayaan untuk membentuk anion caj a -1. Konfigurasi elektronnya ditulis sebagai 1s2 2s2 2p6 3s2 3p5. Sejak p Tahap sub harus mempunyai 6 elektron untuk mendapatkan argon, konfigurasi elektron gas mulia, klorin mempunyai keupayaan untuk menarik elektron.
Dengan tarikan elektrostatik antara k+ kation dan cl- Anion, KCl telah memperoleh struktur kekisi. Struktur kristal ini adalah struktur padu berpusatkan wajah. Jisim molar kalium klorida adalah 74.5513 g mol-1. Titik leburnya adalah kira -kira 770 ° C, dan titik mendidih ialah 1420 ° C.
Potassium Chloride terutamanya digunakan untuk membuat baja kerana tumbuhan memerlukan kalium untuk pertumbuhan dan perkembangan mereka. Menjadi garam KCl sangat larut dalam air. Oleh itu, ia dengan mudah melepaskan kalium ke dalam air tanah, sehingga tumbuh -tumbuhan dapat mengambil kalium dengan mudah. Ini juga digunakan dalam ubat dan pemprosesan makanan. Selanjutnya, bagi tujuan kimia, kalium klorida digunakan dalam membuat kalium hidroksida dan kalium logam.
Potassium gluconate
Garam kalium asid glukonik dikenali sebagai kalium glukonat. Kumpulan asid karboksilik asid glukonik bertindak balas dengan kalium untuk menghasilkan garam ini. Ia mempunyai struktur berikut.
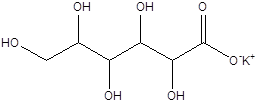
Oleh kerana kalium adalah elemen penting bagi badan kita, bekalan kalium harus dikekalkan. Perubahan dalam tahap kalium boleh menyebabkan banyak penyakit kepada manusia. Potassium Gluconate adalah satu bentuk membekalkan kalium ke dalam badan kita. Oleh kerana ion kalium longgar terikat dengan molekul, ia mudah dihantar ke sel. Selain itu, ia sangat larut dalam air; oleh itu mudah diserap ke dalam badan. Ini diberikan sebagai makanan tambahan, dan ia datang sebagai tablet dan dalam bentuk cecair.
Walaupun jarang dilaporkan, kalium glukonat boleh menyebabkan kesan sampingan yang serius seperti sakit perut, sakit dada atau tekak, dll. Semasa mengambil kalium glukonat, terdapat beberapa batasan. Sebagai contoh, orang yang mengalami kegagalan buah pinggang, jangkitan saluran kencing, diabetes yang tidak terkawal, ulser peptik di perut, penyakit Addison, dan luka bakar teruk atau kecederaan tisu lain tidak boleh mengambil ini.
Kalium klorida vs kalium glukonat
- Kalium klorida adalah garam tak organik manakala kalium glukonat adalah garam organik kalium.
- KCl mudah larut dalam air daripada kalium glukonat.
- Glukonat kalium diberikan sebagai suplemen jika pesakit mempunyai tahap klorida biasa. Potassium Chloride diberikan jika terdapat tahap rendah kalium dan klorida dalam darah.


