Perbezaan antara alkalinity P dan kealaya
Perbezaan Utama - PCalinity vs MCalinity
Kealkalian istilah merujuk kepada jumlah larutan akueus yang diperlukan untuk meneutralkan keasidan yang disebabkan oleh asid. Walaupun kealkalian berkaitan dengan asas penyelesaian berair seperti air, darah, dan lain -lain., ia mengukur rintangan penyelesaian ke arah perubahan pH kerana kehadiran asid. Ion utama yang menyumbang kepada kealkalian air adalah ion hidroksil (OH-), Ion karbonat (CO32-) dan ion bikarbonat (HCO3-). Alkaliniti dikategorikan kepada tiga kumpulan mengikut titik akhir yang diberikan apabila penyelesaian asas berair dititrasi dengan asid. Alkaliniti kaustik, alkalinity p, dan alkalinity m adalah kategori ini. Artikel ini memberi tumpuan kepada perbezaan antara alkalinity P dan MCalinity. Nama Palkali P dan Malkali M diberi bergantung kepada penunjuk yang digunakan dalam proses titrasi. Perbezaan utama antara alkalinity P dan kealaya M ialah P alkaliniti menentukan kealkalian semua hidroksil dan separuh daripada karbonat sedangkan m alkalinitas menentukan kealkalian semua hidroksil, karbonat dan bikarbonat. Ke alkaliniti dianggap sebagai alkali umum atau keseluruhan kerana spesies karbonat memainkan peranan utama dalam jumlah alkali air.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu alkalinity
3. Apa itu alkalinity
4. Perbandingan sampingan - P alkalinity vs m alkalinity dalam bentuk jadual
5. Ringkasan
Apa itu alkalinity?
Istilah P Alkalinity bermaksud "Phenolphthalein - Alkalinity". Ia adalah pengukuran hidroksida (oh-) dan ion karbonat (CO3-2) jumlah. Ia ditentukan dengan titrating sampel air dengan asid kepekatan yang diketahui dengan kehadiran phenolphthalein sebagai penunjuk. Untuk memahami apa yang berlaku dalam titrasi ini, penting untuk mengetahui mengenai pemisahan asid karbonik.

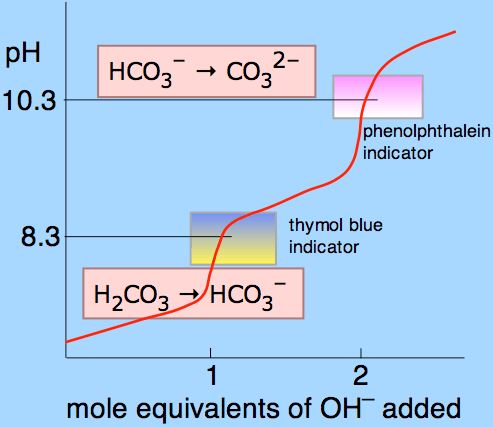
Rajah 01: Kurva titrasi untuk asid karbonik menggunakan phenolphthalein dan thymol biru sebagai petunjuk.
Keluk di atas menunjukkan apa yang berlaku semasa titrasi asid karbonik. Ia adalah asid diprotik dan boleh mengeluarkan dua atom hidrogen yang dipanggil proton. Bahagian atas lengkung menunjukkan bahawa jumlah ion karbonat dan hidroksil diberikan dalam julat pH phenolphthalein. Sejak julat pH di mana phenolphthalein memberikan perubahan warna adalah 8.3 - 10.0, alkalinity P diukur dalam julat pH. Di sini, hubungan berikut digunakan untuk menjelaskan kealkalian sampel tertentu yang digunakan untuk titrasi.
1 ml asid = 1 meq/l alkalinity
Apa itu alkalinity?
Jumlah pengukuran hidroksida (OH-), bikarbonat (HCO3-) dan karbonat (CO32-) Jumlah ion diberikan oleh kealkalian m. Huruf m merujuk kepada metil oren. Ia adalah penunjuk yang digunakan untuk menentukan jumlah alkali yang diberikan oleh spesies hidroksida dan karbonat di atas. Apabila metil oren ditambah, ia memberikan perubahan warna hanya dalam julat pHnya, 3.1 - 4.4. Oleh kerana hanya mengesan kepekatan asid lain yang dibubarkan di dalam air kecuali asid karbonik, kealkalian M dapat dianggap sebagai jumlah alkalinitas kerana ia memberikan jumlah alkalinitas karbonat.
Apakah perbezaan antara alkalinity P dan MCalinity?
P alkalinity vs m alkalinity | |
| P alkalinitas adalah pengukuran kealkalian yang diberikan oleh ion hidroksida dan separuh daripada alkaliniti karbonat. | Ke alkalinitas adalah pengukuran kealkalian yang diberikan oleh ion hidroksida dan jumlah alkaliniti karbonat. |
| Penunjuk | |
| Petunjuk Phenolphthalein digunakan untuk menentukan PCalinity P. | Metil oren digunakan untuk menentukan kealkalian m. |
| julat pH | |
| P alkalinitas diukur pada lingkungan 8.3 - 10.0 Ph. | alkalinity m diukur pada julat pH 3.1 - 4.4. |
| Spesies karbonat | |
| P alkalinity terutamanya menentukan oh- dan HCO3- spesies. | m alkalinity menentukan oh-, HCO3- dan co32- spesies. |
Ringkasan -PCalinity vs M Alkalinity
Dengan mengukur alkalinitas P dan kealaya, seseorang dapat mengira jumlah karbon bukan organik yang dibubarkan dalam sampel. Sejumlah asid secara semula jadi dibubarkan di dalam air tetapi dalam kepekatan jejak. Walau bagaimanapun, asid karbonik didapati dalam kepekatan tinggi kerana CO2 boleh larut dalam air. Oleh itu, jumlah kealkalian air sering sama dengan kealkalian karbonat. Perbezaan utama antara alkalinitas dan alkalinitas adalah bahawa alkalinitas adalah pengukuran kealkalian yang diberikan oleh ion hidroksida dan separuh dari alkalinitas karbonat manakala kealkalian M adalah pengukuran alkalinitas yang diberikan oleh ion hidroksida dan jumlah alkali karbonat.
Muat turun versi PDF PCalinity vs M Alkalinity
Anda boleh memuat turun versi PDF artikel ini dan menggunakannya untuk tujuan luar talian mengikut nota petikan. Sila muat turun versi pdf di sini perbezaan antara alkalinity dan alkalinity m.
Rujukan:
1."Titrasi asid poliprotik yang lemah."Kimia Teks Libre. N.p., 6 Jan. 2016. Web. Terdapat di sini. 5 Jun 2017.
Ihsan gambar:
1. "Titcurve H2CO3" oleh kerja yang lebih perlahan (CC BY -SA 3.0) melalui Commons Wikimedia


