Perbezaan antara nitrogen monoksida dan dinitrogen pentoxide
The Perbezaan utama Antara nitrogen monoksida dan dinitrogen pentoxide ialah nitrogen monoksida adalah gas tanpa warna manakala dinitrogen pentoxide adalah pepejal putih.
Nitrogen monoksida dan dinitrogen pentoxide adalah sebatian kimia yang mengandungi nitrogen dan oksigen. Ini adalah oksida nitrogen. Walau bagaimanapun, mereka mempunyai sifat kimia dan fizikal yang berbeza.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu nitrogen monoksida
3. Apa itu Dinitrogen Pentoxide
4. Perbandingan sampingan - nitrogen monoksida vs dinitrogen pentoxide dalam bentuk tabular
5. Ringkasan
Apa itu nitrogen monoksida?
Nitrogen monoksida adalah sebatian bukan organik yang mempunyai formula kimia no. Kami menyebutnya nitrat oksida kerana ia adalah oksida nitrogen. Ia sebenarnya radikal bebas kerana ia mempunyai elektron yang tidak berpasangan. Selain itu, ia adalah molekul diatomik heteronuklear.
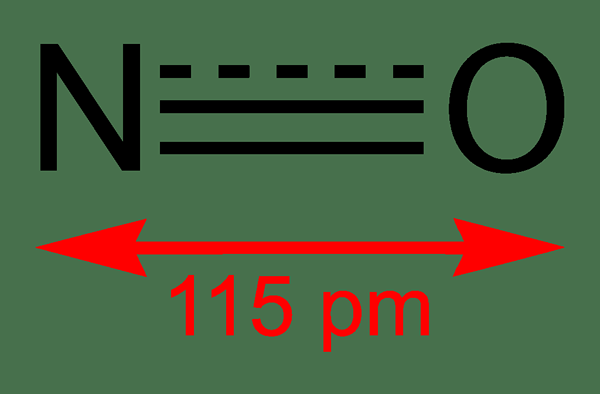
Rajah 01: Struktur nitrogen monoksida dan panjang ikatan antara n dan o
Jisim molar sebatian ini adalah 30 g/mol. Ia berlaku sebagai gas tidak berwarna. Di samping itu, titik leburnya ialah -164 ° C manakala titik mendidih ialah -152 ° C, yang merupakan nilai yang sangat kecil jika dibandingkan dengan oksida lain nitrogen. Kita boleh menghasilkan radikal bebas ini melalui pengoksidaan ammonia pada 850 ° C dengan kehadiran pemangkin platinum. Walau bagaimanapun, pada skala makmal, kita dapat menyediakannya dengan pengurangan asid nitrik cair dengan tembaga.
Apa itu Dinitrogen Pentoxide?
Dinitrogen Pentoxide adalah sebatian bukan organik yang mempunyai formula kimia n2O5. Kami menyebutnya nitrogen pentoksida. Ia adalah oksida nitrogen binari. Selain itu, ia tidak stabil dan boleh bertindak sebagai pengoksida berbahaya. Jisim molar sebatian adalah 108.01 g/mol. Ia berlaku pepejal warna putih.

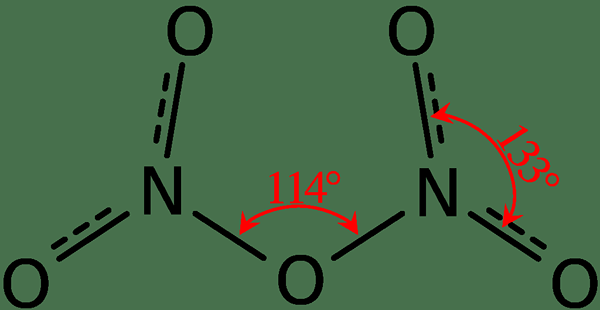
Rajah 02: Struktur Dinitrogen Pentoxide
Tambahan pula, titik lebur sebatian ini adalah 41 ° C dan, pada suhu 47 ° C ini mengalami penyejatan. Kompaun ini bertindak balas dengan air, memberikan asid nitrik. Di samping itu, bentuk molekul molekul pentoxide dinitrogen adalah planar. Kita boleh menghasilkan sebatian ini melalui asid nitrik dehidrasi dengan fosforus pentoksida.
Apakah perbezaan antara nitrogen monoksida dan dinitrogen pentoxide?
Nitrogen monoksida adalah sebatian bukan organik yang mempunyai formula kimia tidak manakala dinitrogen pentoxide adalah sebatian bukan organik yang mempunyai formula kimia n2O5. Perbezaan utama antara nitrogen monoksida dan dinitrogen pentoxide ialah nitrogen monoksida adalah gas tanpa warna manakala dinitrogen pentoxide adalah pepejal putih. Selain itu, kita dapat menghasilkan nitrogen monoksida melalui pengoksidaan ammonia pada 850 ° C dengan kehadiran pemangkin platinum. Walau bagaimanapun, pengeluaran pentoksida dinitrogen adalah melalui asid nitrik dehidrasi dengan fosforus pentoksida. Apabila mempertimbangkan bentuk molekul, nitrogen monoksida linear manakala dinitrogen pentoxide adalah planar.
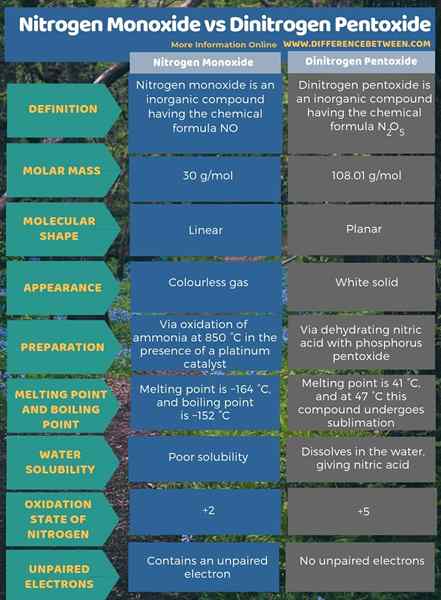
Ringkasan -Nitrogen Monoxide vs Dinitrogen Pentoxide
Nitrogen monoksida adalah sebatian bukan organik yang mempunyai formula kimia tidak manakala dinitrogen pentoxide adalah sebatian bukan organik yang mempunyai formula kimia n2O5. Perbezaan utama antara nitrogen monoksida dan dinitrogen pentoxide ialah nitrogen monoksida adalah gas tanpa warna manakala dinitrogen pentoxide adalah pepejal putih.
Rujukan:
1. Mowry, Curtis, et al. "Aktiviti Pencirian Bahan untuk" Ambil Anak -Anak & Anak -anak kami ke Hari Kerja "2013."Jan. 2013, doi: 10.2172/1096449.
Ihsan gambar:
1. "Nitric-Oxide-2d" oleh Yiny. - Kerja sendiri (domain awam) melalui Wikimedia Commons
2. "Dinitrogen Pentoxide" oleh Krishnavedala - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia


