Perbezaan antara nombor kuantum magnet dan nombor kuantum putaran
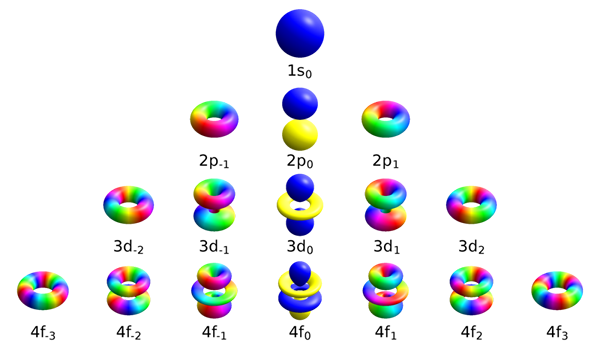
The Perbezaan utama antara nombor kuantum magnet dan nombor kuantum putaran ialah Nombor kuantum magnet berguna dalam membezakan orbital yang terdapat dalam subshells, sedangkan nombor kuantum spin menggambarkan tenaga, bentuk dan orientasi orbital.
Nombor kuantum adalah satu set nilai yang menggambarkan keadaan kuantum unik elektron dalam atom. Terdapat empat nombor kuantum tertentu: nombor kuantum utama, nombor kuantum sudut, nombor kuantum magnet dan nombor kuantum putaran.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah nombor kuantum magnet
3. Apakah nombor kuantum putaran
4. Perbandingan sampingan -Nombor kuantum magnet vs nombor kuantum spin dalam bentuk jadual
5. Ringkasan
Apakah nombor kuantum magnet?
Nombor kuantum magnet membezakan orbital yang terdapat dalam subshells. Simbol untuk nilai ini adalah mi. Menurut definisi, nombor kuantum ini menyatakan bahawa elektron dalam setiap subshell tertentu mempunyai nombor kuantum sudut yang berkisar dari -l hingga +l ditambah sifar. Oleh itu, subshells s, p, d dan f mengandungi bilangan orbital yang berlainan. Jadual berikut menunjukkan bilangan orbital yang terdapat di setiap subshell.
| Subshell | Nilai untuk nombor kuantum magnet | Bilangan orbital |
| s | mi= 0 | 1 |
| p | mi= -1,0,+1 | 3 |
| d | mi= -2, -1,0,+1,+2 | 5 |
| f | mi= -3, -2, -1,0,+1,+2,+3 | 7 |
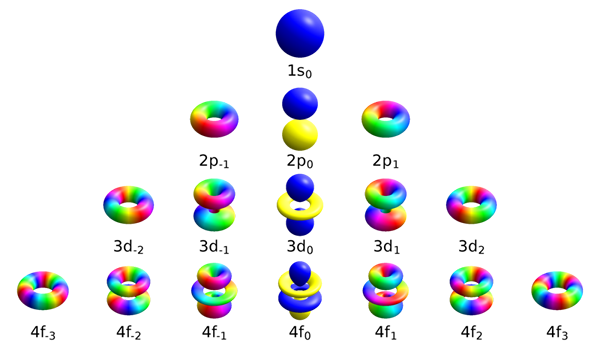
Nombor kuantum magnet menentukan peralihan tenaga orbital yang berlaku kerana medan magnet yang digunakan secara luaran. Kami panggil kesan ini "kesan zeeman". Momen magnet sebenar timbul dari dua faktor: momen sudut elektron dan spin elektron, yang diterangkan dari nombor kuantum magnet.
Apakah nombor kuantum putaran?
Nombor kuantum putaran menggambarkan tenaga, bentuk dan orientasi orbital. Simbol untuk nilai ini adalah "s". Nombor kuantum putaran adalah parameter momentum sudut intrinsik atom. Momentum sudut putaran elektron dalam orbital diberikan sebagai s = 1/2.
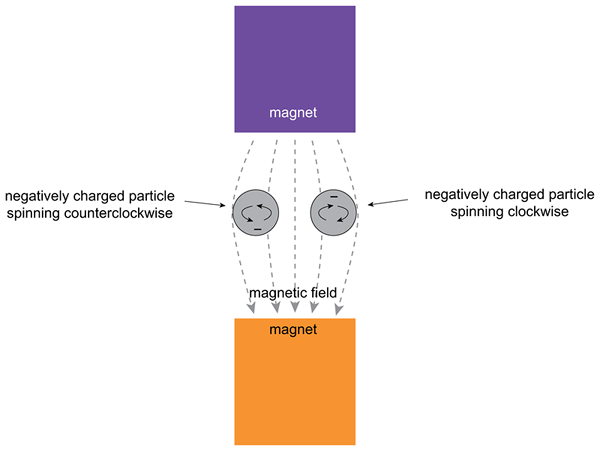
Rajah 02: Kesan medan magnet luaran pada elektron
Orbital boleh mengandungi sepasang elektron; Oleh itu, kedua-dua elektron mempunyai nombor kuantum s = -1/2 dan s =+1/2 spin. Ia merujuk kepada orientasi "spin-up" dan "spin-down" elektron. Nombor kuantum menentukan keadaan kuantum elektron tertentu atom. Tambahan pula, kita dapat memberikan "jumlah kuantum spin" (s), yang pasangan berputar beberapa elektron yang tidak berpasangan dari beberapa atom tertentu.
Apakah perbezaan antara nombor kuantum magnet dan nombor kuantum putaran?
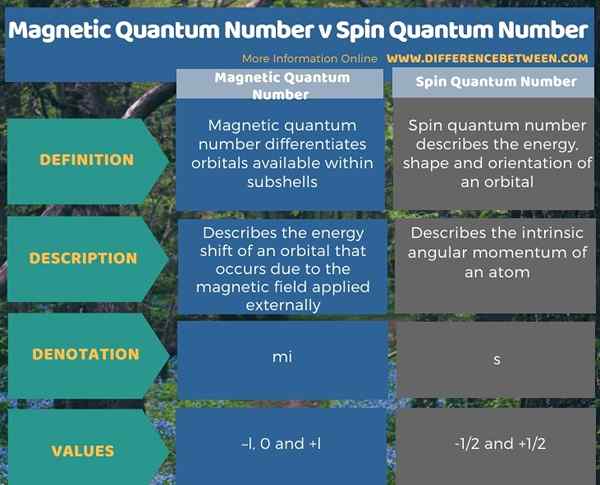
Nombor kuantum adalah satu set nilai yang menggambarkan keadaan kuantum unik elektron dalam atom. Perbezaan utama antara nombor kuantum magnet dan nombor kuantum spin ialah nombor kuantum magnet berguna dalam membezakan orbital yang terdapat dalam subshells, sedangkan nombor kuantum spin menerangkan tenaga, bentuk dan orientasi orbital. Nilai untuk nombor kuantum magnet diberikan sebagai -l, 0 dan +l. Simbol untuk nilai ini adalah mi. Tetapi, nombor kuantum putaran diberikan sebagai -1/2 dan +1/2. Simbol untuk nilai ini adalah "s".
Selain itu, perbezaan selanjutnya antara nombor kuantum magnet dan nombor kuantum spin ialah nombor kuantum magnet menerangkan peralihan tenaga orbital yang berlaku kerana medan magnet yang digunakan secara luaran, manakala nombor kuantum spin menggambarkan momentum sudut intrinsik.
Ringkasan -Nombor kuantum magnet vs nombor kuantum spin
Nombor kuantum adalah satu set nilai yang menggambarkan keadaan kuantum unik elektron dalam atom. Perbezaan utama antara nombor kuantum magnet dan nombor kuantum spin ialah nombor kuantum magnet berguna dalam membezakan orbital yang terdapat dalam subshells, sedangkan nombor kuantum spin menerangkan tenaga, bentuk dan orientasi orbital.
Rujukan:
1. "Nombor kuantum untuk atom."Kimia Libretexts, Libretexts, 27 Sept. 2019, boleh didapati di sini.
2. "Nombor kuantum magnet."Wikipedia, Yayasan Wikimedia, 16 Nov. 2019, boleh didapati di sini.
3. "Nombor kuantum putar."Wikipedia, Yayasan Wikimedia, 1 Sept. 2019, boleh didapati di sini.
4. Helmenstine, Anne Marie. "Definisi nombor kuantum putaran."Thoughtco, dec. 7, 2018, boleh didapati di sini.
Ihsan gambar:
1. "Orbital Atom SPDF M -Eigenstates" oleh Geek3 - Kerja Sendiri, Dibuat dengan Hidrogen 1.1 (cc by-sa 4.0) melalui Commons Wikimedia
2. "Dua zarah bercas negatif berputar dalam medan magnet" oleh Yayasan CK -12 - Fail: Kimia Sekolah Tinggi.PDF, Page 280 (CC BY-SA 3.0) melalui Commons Wikimedia


