Perbezaan antara elemen kumpulan 1 dan kumpulan 2
The Perbezaan utama Antara elemen kumpulan 1 dan kumpulan 2 ialah Semua elemen Kumpulan 1 mempunyai elektron yang tidak berpasangan di orbital paling luar mereka, sedangkan elemen kumpulan 2 mempunyai elektron berpasangan di orbital paling luar mereka.
Kumpulan 1 dan 2 dari jadual berkala mengandungi elemen blok S. Maksudnya; Unsur -unsur ini mempunyai elektron paling luar di orbital s. Kumpulan 1 dan 2 berbeza antara satu sama lain bergantung kepada bilangan elektron di orbital paling luar mereka. Satu orbital s boleh mengandungi hanya dua elektron kerana bilangan kuantum magnet orbital ini adalah 0.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah elemen kumpulan1
3. Apakah elemen kumpulan 2
4. Perbandingan sampingan - Kumpulan1 vs kumpulan 2 elemen dalam bentuk jadual
5. Ringkasan
Apakah elemen kumpulan 1?
Unsur Kumpulan 1 adalah unsur -unsur kimia yang mempunyai elektron yang tidak berpasangan di orbital paling luar. Ia adalah lajur pertama blok S jadual berkala. Ia mengandungi logam hidrogen dan alkali. Ahli -ahli kumpulan 1 ini adalah seperti berikut:
- Hidrogen (H)
- Lithium (li)
- Natrium (NA)
- Potassium (k)
- Rhubidium (RH)
- Cesium (cs)
- Francium (FR)

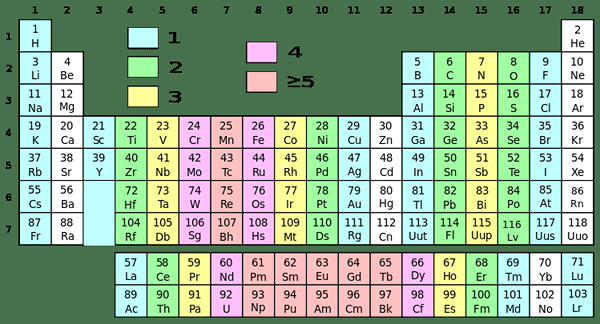
Rajah 01: Jadual berkala dengan kumpulan yang berbeza dalam pelbagai warna
Walaupun hidrogen berada dalam kumpulan ini kerana konfigurasi elektronnya, ia mempunyai ciri -ciri yang berbeza dari logam alkali. Contohnya, hidrogen wujud sebagai gas, sementara unsur -unsur lain dalam kumpulan ini adalah logam. Logam ini semua berkilat, sangat reaktif, dan sangat lembut (kita dapat dengan mudah memotongnya menggunakan pisau mudah).
Umumnya, elemen kumpulan 1 menunjukkan kepadatan rendah, titik lebur yang rendah, titik mendidih rendah dan mempunyai struktur kristal padu berpusatkan badan. Selain itu, mereka mempunyai warna api yang berbeza, jadi kami dapat dengan mudah membezakannya dengan mendedahkan sampel ke pembakar bunsen. Apabila turun kumpulan logam alkali, terdapat beberapa variasi berkala seperti yang disenaraikan di bawah.
- Saiz atom meningkat
- Titik lebur dan titik mendidih menurun kerana keupayaan untuk membentuk ikatan yang kuat menurun ke bawah kumpulan (apabila atom menjadi besar, ikatan yang terbentuk lemah).
- Ketumpatan meningkat.
- Tenaga pengionan pertama berkurangan kerana pada atom besar, elektron paling luar terikat dan mudah dikeluarkan.
- Elektronegativiti
- Kereaktifan berkurangan.
- Logam Alkali mempunyai pertalian elektron yang rendah daripada elemen lain.
Apakah elemen kumpulan 2?
Elemen Kumpulan 2 adalah unsur -unsur kimia yang mempunyai pasangan elektron paling luar mereka dalam orbital s. Oleh itu, elektron valensi mereka dalam bentuk NS2. Selanjutnya, kumpulan ini adalah lajur kedua blok S. Kami namakan mereka sebagai logam bumi alkali. Ahli -ahli kumpulan ini adalah seperti berikut:
- Beryllium (BE)
- Magnesium (mg)
- Kalsium (CA)
- Strontium (SR)
- Barium (BA)
- Radium (ra)
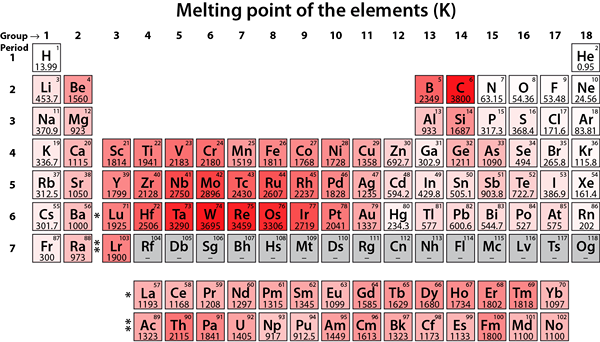
Rajah 02: Titik lebur elemen
Unsur -unsur logam ini cenderung untuk menstabilkan konfigurasi elektron mereka dengan mengeluarkan dua elektron paling luar untuk mendapatkan konfigurasi elektron gas mulia. Oleh itu, unsur -unsur ini cenderung membentuk +2 kation. Logam ini kurang reaktif berbanding dengan elemen kumpulan 1. Selain itu, unsur -unsur ini mempunyai titik lebur yang lebih tinggi berbanding elemen kumpulan 1, dan hidroksida mereka agak kurang asas.
Apakah perbezaan antara elemen kumpulan 1 dan kumpulan 2?
Kumpulan 1 dan 2 berbeza antara satu sama lain bergantung kepada bilangan elektron di orbital paling luar mereka. Perbezaan utama antara elemen Kumpulan 1 dan Kumpulan 2 ialah semua elemen Kumpulan 1 mempunyai elektron yang tidak berpasangan di orbital paling luar mereka, sedangkan unsur -unsur kumpulan 2 mempunyai elektron berpasangan di orbital terluar mereka.
Infographic di bawah menunjukkan lebih banyak perbandingan mengenai perbezaan antara elemen kumpulan 1 dan kumpulan 2.
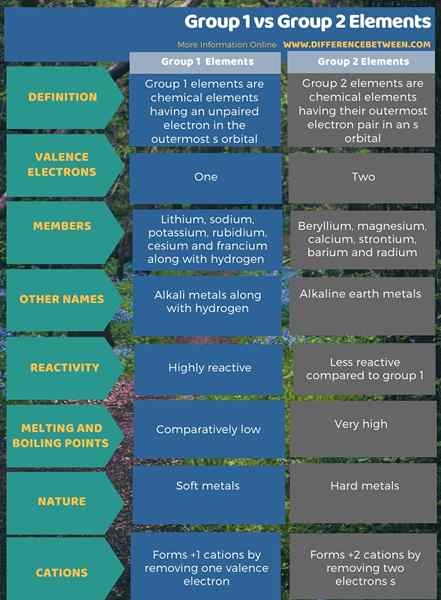
Ringkasan -Kumpulan 1 vs kumpulan 2 elemen
Kumpulan 1 dan 2 berbeza antara satu sama lain bergantung kepada bilangan elektron di orbital paling luar mereka. Perbezaan utama antara elemen Kumpulan 1 dan Kumpulan 2 ialah semua elemen Kumpulan 1 mempunyai elektron yang tidak berpasangan di orbital paling luar mereka, sedangkan unsur -unsur kumpulan 2 mempunyai elektron berpasangan di orbital terluar mereka.
Rujukan:
1."Kumpulan 1: Hidrogen dan Logam Alkali."Kimia Libretexts, Libretexts, 23 Jun 2019, boleh didapati di sini.
2. Helmenstine, Anne Marie. "Jadual berkala kumpulan elemen."Thoughtco, Nov. 11, 2019, boleh didapati di sini.
Ihsan gambar:
1. "Jadual berkala dengan elektron yang tidak berpasangan" oleh KES47-versi SVG dari imej JPG yang dicipta oleh SAI2020 pada 2009-02-03: Fail: Jadual berkala dengan E tidak berpasangan E-.JPG, (Domain Awam) melalui Commons Wikimedia
2. "Titik lebur unsur -unsur (k)" oleh Albris - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


