Perbezaan antara undang -undang komposisi berterusan dan undang -undang pelbagai perkadaran
The Perbezaan utama antara undang -undang komposisi berterusan dan undang -undang pelbagai perkadaran adalah bahawa Mengikut undang -undang komposisi yang berterusan, bahagian sampel yang sama selalu terdiri daripada bahagian unsur yang sama dengan jisim, sedangkan menurut undang -undang pelbagai perkadaran, jika dua elemen mengikat antara satu sama lain yang membentuk lebih dari satu sebatian kimia, maka nisbahnya Antara jisim elemen kedua yang menggabungkan dengan jisim tetap elemen pertama mempunyai nisbah bilangan keseluruhan kecil.
Undang -undang komposisi yang berterusan dan undang -undang pelbagai perkadaran adalah teori dalam kimia fizikal yang digunakan untuk menjelaskan stoikiometri dalam kimia. Stoikiometri adalah ukuran kuantiti relatif reaktan dan produk dalam tindak balas kimia.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah undang -undang komposisi yang berterusan
3. Apakah undang -undang pelbagai perkadaran
4. Perbandingan sampingan - Undang -undang komposisi berterusan vs undang -undang pelbagai perkadaran dalam bentuk jadual
5. Ringkasan
Apakah undang -undang komposisi yang berterusan?
Undang -undang komposisi tetap menyatakan sampel sebatian akan selalu mengandungi bahagian unsur yang sama dengan jisim. Kita boleh menamakan undang -undang ini sebagai undang -undang perkadaran pasti. Undang -undang ini menerangkan bahawa sebatian yang diberikan akan selalu mengandungi unsur -unsur yang sama dalam perkadaran yang sama dengan jisim.
Sebagai contoh, sama ada air paip atau air laut, molekul air akan sentiasa mengandungi unsur hidrogen dan oksigen dalam perkadaran berikut. Formula kimia molekul air adalah H2O, dan jisim molar molekul ini adalah 18 g/mol. Oleh itu, satu tahi lalat air mengandungi 18 g H2O. Nisbah antara H dan O dalam molekul air ialah 2: 1. Sehubungan itu, pecahan massa hidrogen dalam air = (2g / 18g) x 100% = 11.11% dan pecahan massa oksigen = (16g/18g) x 100% = 88.89%. Pecahan ini tetap dan tidak berubah mengikut sumber air dan kaedah pemisahan.
Undang -undang komposisi malar bergantung pada fakta bahawa mana -mana atom elemen yang sama (atom yang mempunyai nombor atom yang sama) sama antara satu sama lain. Memandangkan contoh di atas, andaian adalah bahawa sebarang atom hidrogen adalah serupa dengan atom hidrogen yang lain dan sebaliknya. Tetapi ada juga beberapa pengecualian. E.g. Komposisi isotop elemen boleh berbeza -beza bergantung kepada sumber. Oleh itu, stoikiometri menunjukkan variasi bergantung kepada sumber elemen.
Apakah undang -undang pelbagai perkadaran?
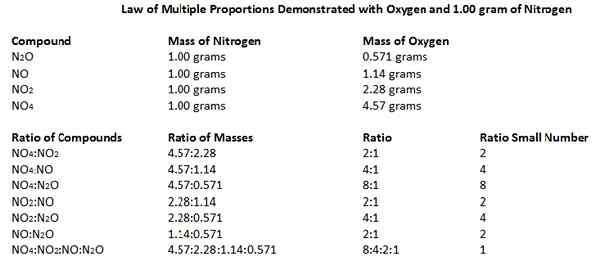
Undang -undang pelbagai perkadaran menyatakan bahawa apabila dua elemen bergabung antara satu sama lain untuk membentuk lebih dari satu kompaun, maka berat satu elemen yang bergabung dengan berat tetap yang lain berada dalam nisbah jumlah kecil yang kecil.

Kita boleh memanggil undang -undang ini undang -undang Dalton juga kerana undang -undang telah dibangunkan oleh John Dalton pada tahun 1803. Marilah kita memahami undang -undang ini menggunakan contoh.
Oksida nitrogen terdiri daripada atom nitrogen dan oksigen. Kami dapat mengenal pasti lima oksida nitrogen yang berbeza yang wujud: n2O, tidak, n2O3, Tidak2 dan n2O5. Memandangkan nisbah jisim N dan O dalam sebatian oksida ini, 14 gram atom nitrogen menggabungkan dengan 8, 16, 24, 32 dan 40 gram oksigen mengikut nisbah massa, masing -masing. Sekiranya kita mengambil nombor -nombor ini sebagai kecil, nombor keseluruhan, maka nisbah boleh diberikan sebagai 1: 1, 1: 2, 1: 3, 1: 4 dan 1: 5.
Apakah perbezaan antara undang -undang komposisi berterusan dan undang -undang pelbagai perkadaran?
Mengikut undang -undang komposisi yang berterusan, bahagian sampel yang sama selalu terdiri daripada bahagian unsur yang sama dengan jisim, sedangkan menurut undang -undang pelbagai perkadaran, jika dua elemen mengikat antara satu sama lain yang membentuk lebih dari satu sebatian kimia, maka nisbahnya Antara jisim elemen kedua yang menggabungkan dengan jisim tetap elemen pertama mempunyai nisbah bilangan keseluruhan kecil. Jadi, ini adalah perbezaan utama antara undang -undang komposisi berterusan dan undang -undang pelbagai perkadaran.

Ringkasan -Undang -undang komposisi berterusan vs undang -undang pelbagai perkadaran
Mengikut undang -undang komposisi yang berterusan, bahagian sampel yang sama selalu terdiri daripada bahagian unsur yang sama dengan jisim, sedangkan menurut undang -undang pelbagai perkadaran, jika dua elemen mengikat antara satu sama lain yang membentuk lebih dari satu sebatian kimia, maka nisbahnya Antara jisim elemen kedua yang menggabungkan dengan jisim tetap elemen pertama mempunyai nisbah bilangan keseluruhan kecil. Oleh itu, ini adalah perbezaan antara undang -undang komposisi berterusan dan undang -undang pelbagai perkadaran.
Rujukan:
1. Helmenstine, Anne Marie. "Undang -undang komposisi berterusan dalam kimia."Thoughtco, Aug. 26, 2020, boleh didapati di sini.
Ihsan gambar:
1. "Demonstrasi Undang -undang Pelbagai Perkadaran" oleh Kenji Agari - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia


