Perbezaan antara kd dan km
Perbezaan utama - kd vs km
Kd dan km adalah pemalar keseimbangan. Perbezaan utama antara kd dan km ialah KD adalah pemalar termodinamik sedangkan km bukan pemalar termodinamik.
KD merujuk kepada pemisahan pemisahan manakala km adalah michaelis constant. Kedua -dua pemalar ini sangat penting dalam analisis kuantitatif tindak balas enzimatik.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu KD
3. Apa itu km
4. Perbandingan sampingan - kd vs km dalam bentuk jadual
5. Ringkasan
Apa itu KD?
KD adalah pemisahan pemisahan. Ia juga dikenali sebagai Keseimbangan pemisahan keseimbangan kerana penggunaannya dalam sistem keseimbangan. Pemalar pemisahan adalah keseimbangan reaksi keseimbangan di mana sebatian besar ditukar kepada komponen kecil. Proses penukaran ini juga dikenali sebagai pemisahan. Molekul ionik selalu memisahkan ionnya. Maka pemisahan pemalar atau kd adalah kuantiti yang menyatakan sejauh mana bahan tertentu dalam penyelesaian memisahkan ke dalam ion. Oleh itu, ini adalah sama dengan produk kepekatan ion masing-masing yang dibahagikan dengan kepekatan molekul yang tidak dibersihkan.
Ab ↔ a +b
Dalam tindak balas umum di atas, pemisahan pemisahan, KD boleh diberikan seperti di bawah.
Kd = [a] [b] / [ab].
Selain itu, jika terdapat hubungan stoikiometri, seseorang harus memasukkan pekali stoikiometrik dalam persamaan.
xab ↔ aa +bb
Persamaan pemisahan pemisahan, KD untuk tindak balas di atas adalah seperti berikut:
Kd = [a]a[B]b / [Ab]x
Khususnya, dalam aplikasi biokimia, KD membantu menentukan jumlah produk yang diberikan oleh tindak balas kimia dengan kehadiran enzim. KD reaksi enzimatik mengekspresikan pertalian ligand-reseptor. Dalam erti kata lain, ia menyatakan keupayaan substrat untuk meninggalkan reseptor enzim. Sebaliknya, ia menerangkan betapa kuatnya substrat yang mengikat enzim.
Apa itu km?
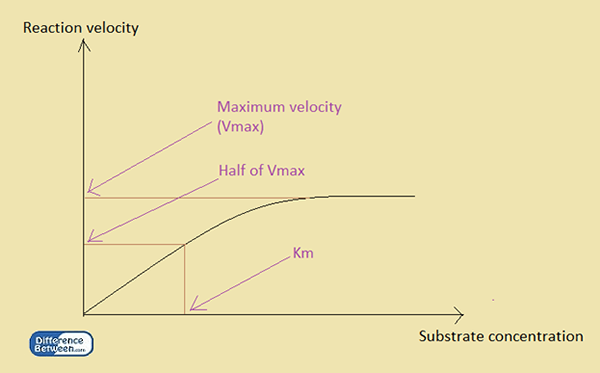
Km adalah michaelis constant. Tidak seperti KD, km adalah pemalar kinetik. Aplikasi utamanya adalah dalam kinetik enzim, iaitu, untuk menentukan pertalian substrat untuk mengikat dengan enzim. Pemalar dinyatakan dengan mengaitkan kepekatan substrat kepada kadar tindak balas dengan kehadiran enzim. Sehubungan itu, pemalar Michaelis atau km adalah kepekatan substrat apabila kelajuan tindak balas mencapai separuh kelajuan maksimumnya.

Rajah 1: Hubungan antara halaju tindak balas dan kepekatan substrat dalam tindak balas enzimatik.
Semasa tindak balas antara enzim (e) dan substrat (s), pembentukan produk (p) adalah seperti berikut:
E + S ↔ E-S Kompleks ↔ E + P
Sekiranya pemalar keseimbangan tindak balas di atas adalah seperti berikut, anda boleh memperoleh km dari pemalar ini.
Km = k-1 + K+2 /K+1
Penentuan km mengikut konsep Michael
Michaelis membangunkan hubungan menggunakan kepekatan substrat, [s] dan halaju tindak balas maksimum, Vmax. Hubungan antara kepekatan substrat dan km reaksi enzimatik adalah seperti berikut:
v = vmax [s] / km + [s]
v adalah halaju pada bila -bila masa, sementara [s] adalah kepekatan substrat pada masa tertentu, dan vmax adalah halaju maksimum reaksi. Km adalah michaelis berterusan untuk enzim dalam reaksi. Nilai pemalar Michaelis bergantung pada enzim. Oleh itu, nilai kecil km menunjukkan bahawa enzim menjadi tepu dengan sedikit substrat. Kemudian vmax diperolehi pada kepekatan substrat yang rendah. Sebaliknya, nilai km yang tinggi menunjukkan bahawa enzim memerlukan jumlah substrat yang tinggi untuk menjadi tepu.
Apakah perbezaan antara kd dan km?
Kd vs km | |
| KD adalah pemisahan pemisahan. | Km adalah michaelis constant. |
| Alam | |
| KD adalah pemalar termodinamik. | Km adalah pemalar kinetik. |
| Perincian | |
| KD mewakili pertalian substrat ke arah enzim. | Km mewakili hubungan antara kepekatan substrat dan kelajuan tindak balas. |
Ringkasan - kd vs km
KD dan KM adalah pemalar keseimbangan yang menggambarkan sifat reaksi enzimatik. Perbezaan utama antara kd dan km ialah kd adalah pemalar termodinamik sedangkan km bukan pemalar termodinamik.
Rujukan:
1. "Kinetika Michaelis-Menten."Wikipedia, Yayasan Wikimedia, 10 Apr. 2018, boleh didapati di sini.
2. "Pengenalan kepada enzim."Kepekatan substrat (Pengenalan kepada Enzim), tersedia di sini.
3. "Pemisahan pemisahan."Wikipedia, Yayasan Wikimedia, 10 Apr. 2018, boleh didapati di sini.


