Perbezaan antara isotop dan elemen
The Perbezaan utama antara isotop dan elemen adalah bahawa isotop adalah bentuk yang berbeza dari elemen kimia yang sama manakala unsur -unsur adalah spesies atom yang mempunyai bilangan proton yang sama dalam nukleus atom.
Jenis atom yang sama dapat mengalami sedikit perubahan untuk membentuk isotop yang berbeza. Elemen mungkin mempunyai beberapa isotop. Sifat setiap isotop menyumbang kepada sifat elemen. Di sini, kita akan membincangkan secara terperinci mengenai isotop dan unsur -unsur untuk menjelaskan perbezaan antara isotop dan elemen.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu isotop
3. Apa itu elemen
4. Perbandingan sampingan - isotop vs elemen dalam bentuk jadual
5. Ringkasan
Apa itu isotop?
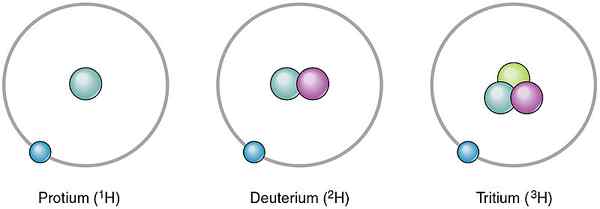
Atom elemen yang sama boleh berbeza antara satu sama lain. Atom -atom yang berbeza dari elemen yang sama adalah isotop. Mereka berbeza antara satu sama lain dengan mempunyai bilangan neutron yang berbeza. Oleh kerana nombor neutron berbeza, nombor jisim mereka juga berbeza. Walau bagaimanapun, isotop elemen yang sama mempunyai bilangan proton yang sama. Secara semula jadi, isotop yang berbeza berlaku dalam kuantiti yang berbeza -beza. Oleh itu, kita dapat memberikan kejadian mereka sebagai nilai peratusan yang disebut kelimpahan relatif. Contohnya, Hidrogen mempunyai tiga isotop seperti Protium, Deuterium dan Tritium. Bilangan proton dalam nukleus atom mereka adalah sama, tetapi bilangan neutron berbeza. Neutron dan kelimpahan relatif mereka adalah seperti berikut.
- 1H - Tiada neutron, kelimpahan relatif adalah 99.985%
- 2H- satu neutron, kelimpahan relatif adalah 0.015%
- 3H- Dua neutron, kelimpahan relatif adalah 0%

Rajah 01: Isotop hidrogen
Bilangan neutron yang boleh dipegang nukleus berbeza dari elemen ke elemen. Di antara isotop ini, hanya ada yang stabil. Contohnya, oksigen mempunyai tiga isotop stabil, dan timah mempunyai sepuluh isotop stabil. Kebanyakan masa, elemen mudah mempunyai nombor neutron yang sama dengan nombor proton. Tetapi dalam unsur -unsur berat, lebih banyak neutron ada di sana daripada bilangan proton.
Selanjutnya, bilangan neutron adalah penting untuk mengimbangi kestabilan nukleus. Apabila nukleus terlalu berat, mereka menjadi tidak stabil dan oleh itu, isotop menjadi radioaktif. Sebagai contoh, 238U memancarkan radiasi dan mereput ke dalam nukleus yang lebih kecil. Isotop mungkin mempunyai sifat yang berbeza kerana orang ramai yang berbeza. Contohnya, mereka boleh mempunyai putaran yang berbeza. Oleh itu, spektrum NMR mereka berbeza. Walau bagaimanapun, nombor elektron mereka adalah serupa menimbulkan tingkah laku kimia yang serupa.
Apa itu elemen?
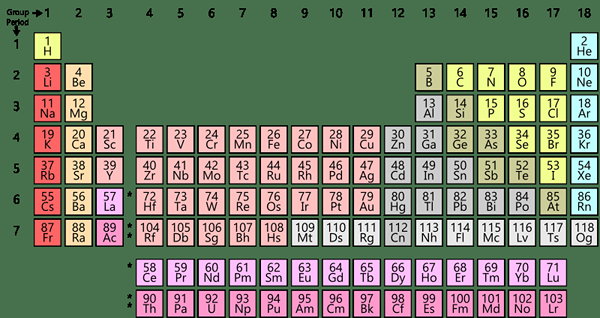
Kita sudah biasa dengan perkataan "elemen," kerana kita belajar mengenainya dalam jadual berkala. Terdapat kira -kira 118 elemen kimia dalam jadual berkala, dan mereka diatur mengikut nombor atom mereka. Unsur adalah spesies kimia, yang mewakili hanya satu jenis atom. Oleh itu, mereka murni. Selanjutnya, atom elemen yang sama mempunyai bilangan proton yang sama dalam nukleus atom mereka. Tetapi, bilangan neutron boleh berbeza antara satu sama lain. Contohnya, elemen terkecil adalah hidrogen. Perak, emas, platinum adalah beberapa unsur berharga yang biasa diketahui.
Setiap elemen mempunyai jisim atom, nombor atom, simbol, konfigurasi elektronik, dan lain -lain. Walaupun kebanyakan elemen secara semula jadi berlaku, terdapat beberapa elemen sintetik seperti Californium, Americium, Einsteinium, dan Mendelevium. Kita boleh mengkategorikan semua elemen kepada tiga kumpulan; sebagai logam, metalloid, dan bukan logam.
Rajah 02: endoskeleton
Selanjutnya, kita dapat mengkategorikannya ke dalam kumpulan dan tempoh berdasarkan ciri -ciri yang lebih spesifik. Juga, elemen dalam kumpulan atau tempoh yang sama berkongsi ciri -ciri umum tertentu, dan beberapa sifat mungkin berubah secara berurutan apabila anda melalui kumpulan atau tempoh. Selain itu, unsur -unsur boleh menjalani perubahan kimia untuk membentuk pelbagai sebatian; Walau bagaimanapun, kita tidak dapat memecahkan elemen dengan kaedah kimia yang mudah.
Apakah perbezaan antara isotop dan elemen?
Elemen kimia istilah menggambarkan spesies atom sementara istilah isotop menggambarkan bentuk yang berbeza dari elemen kimia yang sama. Oleh itu, perbezaan utama antara isotop dan unsur adalah bahawa isotop adalah bentuk yang berbeza dari elemen kimia yang sama manakala unsur -unsur adalah spesies atom yang mempunyai bilangan proton yang sama dalam nukleus atom. Tambahan pula, satu lagi perbezaan antara isotop dan unsur -unsur adalah bahawa isotop mempunyai bilangan neutron yang berlainan, tetapi unsur -unsur kimia boleh mempunyai bilangan neutron yang sama atau bilangan neutron yang berbeza; Tetapi mereka tidak pernah mempunyai bilangan proton yang sama.
Sebagai satu lagi perbezaan penting antara isotop dan unsur -unsur, kita boleh mengatakan bahawa jisim atom isotop dapat dikira dengan hanya menambahkan jumlah jisim proton dan neutron dalam nukleus atom sedangkan kita dapat mengira jisim atom dari unsur kimia menggunakan atom massa isotopnya dan kelimpahan relatifnya.

Ringkasan -Isotop vs elemen
Isotop adalah bentuk atom yang berbeza dari elemen kimia yang sama. Perbezaan utama antara isotop dan elemen adalah bahawa isotop adalah bentuk yang berbeza dari elemen kimia yang sama sedangkan unsur -unsur adalah spesies atom yang mempunyai bilangan proton yang sama dalam nukleus atom.
Rujukan:
1. "Elemen Kimia."Wikipedia, Yayasan Wikimedia, 11 Nov. 2018. Terdapat di sini
2. Helmenstine, Anne Marie, PH.D. "Definisi dan contoh isotop dalam kimia."Thoughtco, Oct. 22, 2018. Terdapat di sini
Ihsan gambar:
1."204 Isotop Hidrogen -01" oleh OpenStax College - Anatomi & Fisiologi, laman web Connexions. (CC oleh 3.0) melalui Commons Wikimedia
2."Chart -en Jadual Berkala Mudah" oleh Offnfopt - Kerja Sendiri, (Domain Awam) melalui Commons Wikimedia