Perbezaan antara isomer dan resonans

Isomers vs Resonance | Struktur Resonans vs Isomer | Isomer perlembagaan, stereoisomer, enantiomer, diastereomers
Molekul atau ion yang mempunyai formula molekul yang sama boleh wujud dengan cara yang berbeza bergantung kepada perintah ikatan, perbezaan pengedaran caj, cara mereka mengatur diri mereka di ruang dan lain -lain.
Isomer
Isomer adalah sebatian yang berbeza dengan formula molekul yang sama. Terdapat pelbagai jenis isomer. Isomer boleh dibahagikan kepada dua kumpulan sebagai isomer perlembagaan dan stereoisomer. Isomer perlembagaan adalah isomer di mana sambungan atom berbeza dalam molekul. Butane adalah alkana yang paling mudah untuk menunjukkan isomerisme perlembagaan. Butane mempunyai dua isomer perlembagaan, butana sendiri dan isobutene.
Ch3Ch2Ch2Ch3 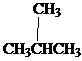
Butana isobutane/ 2-methylpropane
Dalam atom stereoisomer disambungkan dalam urutan yang sama, tidak seperti isomer perlembagaan. Stereoisomer hanya berbeza dalam susunan atom mereka di ruang angkasa. Stereoisomer boleh terdiri daripada dua jenis, enantiomer dan diastereomer. Diastereomer adalah stereoisomer yang molekulnya tidak mencerminkan imej antara satu sama lain. Isomer trans cis dari 1, 2-dichloroethene adalah diastereomers. Enantiomer adalah stereoisomer yang molekulnya adalah imej cermin yang tidak boleh dipertikaikan antara satu sama lain. Enantiomer hanya berlaku dengan molekul kiral. Molekul kiral ditakrifkan sebagai salah satu yang tidak sama dengan imej cerminnya. Oleh itu, molekul kiral dan imej cerminnya adalah enantiomer antara satu sama lain. Sebagai contoh, molekul 2-butanol adalah kiral, dan imej cerminnya adalah enantiomer.
Resonans
Semasa menulis struktur Lewis, kami hanya menunjukkan elektron valensi. Dengan mempunyai atom berkongsi atau memindahkan elektron, kami cuba memberi setiap atom konfigurasi elektronik gas mulia. Walau bagaimanapun, pada percubaan ini, kita boleh mengenakan lokasi buatan di elektron. Akibatnya, lebih daripada satu struktur Lewis yang setara boleh ditulis untuk banyak molekul dan ion. Struktur yang ditulis dengan mengubah kedudukan elektron dikenali sebagai struktur resonans. Ini adalah struktur yang hanya wujud dalam teori. Struktur resonans menyatakan dua fakta mengenai struktur resonans.
- Tiada struktur resonans akan menjadi perwakilan yang betul dari molekul sebenar; tidak ada yang menyerupai sifat kimia dan fizikal molekul sebenar.
- Molekul sebenar atau ion akan diwakili oleh hibrid semua struktur resonans.
Struktur resonans ditunjukkan dengan anak panah ↔. Berikut adalah struktur resonans ion karbonat (CO32-).
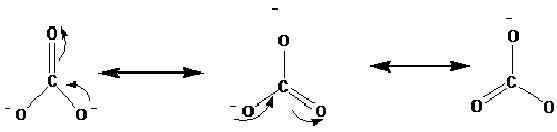
Kajian sinar-X telah menunjukkan bahawa molekul sebenar berada di antara resonans ini. Menurut kajian, semua ikatan karbon-oksigen berada dalam panjang yang sama dalam ion karbonat. Walau bagaimanapun, mengikut struktur di atas, kita dapat melihat satu adalah ikatan berganda, dan dua adalah bon tunggal. Oleh itu, jika struktur resonans ini berlaku secara berasingan, idealnya harus ada panjang ikatan yang berbeza di ion. Panjang ikatan yang sama menunjukkan bahawa tidak ada struktur ini yang sebenarnya ada dalam alam semula jadi, melainkan hibrid ini wujud.
| Apakah perbezaan antara Isomer dan resonans? • Dalam isomer, susunan atom atau susunan ruang molekul mungkin berbeza. Tetapi dalam struktur resonans, faktor -faktor ini tidak berubah. Sebaliknya, mereka hanya mempunyai perubahan kedudukan elektron. • Isomer secara semula jadi hadir, tetapi struktur resonans tidak wujud dalam realiti. Mereka adalah struktur hipotesis, yang hanya terhad kepada teori. |


