Perbezaan antara ion dan elektron
Ion vs elektron
Terdapat banyak perbezaan antara elektron dan ion; saiz, caj, dan alam adalah sebahagian daripada mereka. Elektron dicas zarah mikro dan ion secara negatif sama ada secara negatif atau molekul atau atom yang dicas secara positif. Sifat elektron dijelaskan menggunakan "mekanik kuantum."Tetapi sifat ion dapat dijelaskan menggunakan kimia umum. Elektron (simbol: β- atau ℮-) adalah zarah sub-atom, dan ia tidak mempunyai sub-zarah atau sub-struktur. Tetapi, ion boleh mempunyai struktur yang lebih kompleks dengan sub-komponen.
Apa itu elektron?
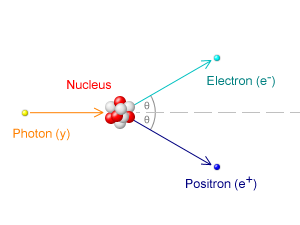
Elektron pertama kali ditemui oleh j.J. Thompson pada tahun 1906 semasa dia bekerja dengan sinar katod yang dipanggil rasuk elektron. Dia mendapati bahawa elektron adalah zarah mikro yang dikenakan secara negatif. Dia biasa memanggil mereka "Corpuscles."Selain itu, dia mendapati bahawa elektron adalah elemen atom dan lebih dari 1000 kali lebih kecil daripada atom hidrogen. Saiz elektron adalah kira -kira 1/1836 proton.
Menurut teori Bohr, elektron mengorbit di sekitar nukleus. Tetapi kemudian, sebagai hasil daripada eksperimen saintifik, didapati bahawa elektron berkelakuan lebih seperti gelombang elektromagnetik daripada mengorbit zarah.

Apa itu ion?
Seperti yang dikatakan sebelum ini, ion sama ada molekul atau atom yang negatif atau positif. Kedua -dua atom dan molekul boleh membentuk ion dengan menerima atau mengeluarkan elektron. Mereka Dapatkan caj positif (k+, Ca2+, Al3+) dengan mengeluarkan elektron dan Dapatkan caj negatif (CL-, S2-, Alo3-) dengan menerima elektron. Apabila ion dibentuk, bilangan elektron tidak sama dengan bilangan proton. Walau bagaimanapun, ia tidak mengubah bilangan proton dalam atom/molekul. Keuntungan atau kehilangan satu atau lebih elektron mempunyai kesan yang signifikan terhadap sifat fizikal dan kimia atom/molekul ibu bapa.
Apakah perbezaan antara elektron dan ion?
• Caj Elektrik:
• Elektron dianggap sebagai zarah asas yang dicas negatif tetapi boleh positif atau negatif.
• Ion dengan caj positif dipanggil "ion positif" dan ion juga dengan caj negatif dipanggil "ion negatif."Ion dibentuk dengan menerima atau menderma elektron.
- Contoh ion positif: NA+, Ca2+, Al3+, Pb4+, NH4+
- Contoh ion negatif: CL-, S2-, Alo3-
• Saiz:
• Elektron adalah zarah yang sangat kecil berbanding dengan ion.
• Saiz ion berbeza -beza bergantung kepada beberapa faktor.
• Saiz elektron adalah nilai tetap; ia adalah kira -kira 1/1836 proton.
• Struktur atom:
• Elektron tidak polyatomik atau monatomi. Elektron tidak bergabung antara satu sama lain untuk membentuk sebatian.
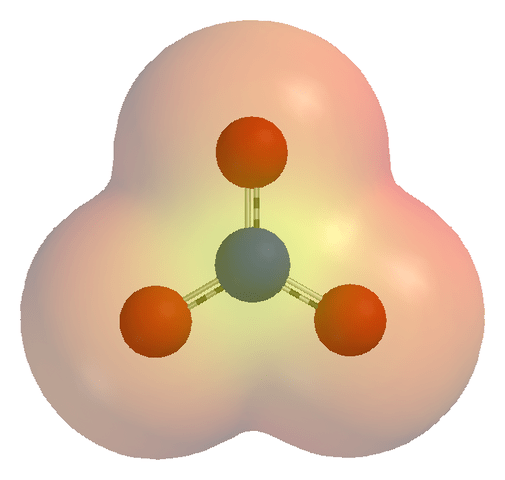
• ion boleh menjadi polyatomik atau monatomi; Ion monatomi mengandungi hanya satu atom manakala ion polyatomik mengandungi lebih daripada satu atom.
- Ion monatomi: na+, Ca2+, Al3+, Pb4+
- Ion Polatomik: CLO3-, Jadi43-
• zarah:
• Elektron adalah zarah mikro dan memiliki sifat gelombang-zarah (dualitas gelombang-zarah).
• ion dianggap sebagai zarah sahaja.
• Unsur:
• Elektron dianggap sebagai zarah unsur. Dengan kata lain, elektron tidak boleh dibahagikan kepada komponen atau substruktur yang lebih kecil.
• Semua ion mempunyai sub-komponen. Sebagai contoh, ion polyatomik mengandungi pelbagai atom; Atom boleh dibahagikan lagi kepada neutron, proton, elektron, dan lain-lain.
• Hartanah:
• Semua elektron mempunyai sifat gelombang yang sama, yang dapat dijelaskan menggunakan mekanik kuantum.
• Ciri -ciri kimia dan fizikal ion berbeza dari ion ke ion. Dengan kata lain, ion yang berbeza mempunyai sifat kimia dan fizikal yang berbeza.
Gambar ihsan:
- Pengeluaran pasangan oleh DavidHorman (CC BY-SA 3.0)
- Peta potensi elektrostatik ion nitrat (no3-) melalui wikicommons (domain awam)


