Perbezaan antara sebatian ionik dan kovalen
Perbezaan Utama - Sebatian Kovalen Ionik Vs
Banyak perbezaan dapat diperhatikan antara sebatian ionik dan kovalen berdasarkan sifat makroskopik mereka seperti kelarutan dalam air, kekonduksian elektrik, titik lebur dan titik mendidih. Sebab utama perbezaan ini adalah perbezaan dalam corak ikatan mereka. Oleh itu, mereka Corak ikatan boleh dianggap sebagai Perbezaan utama antara sebatian ionik dan kovalen. (Perbezaan antara ikatan ionik dan kovalen) Apabila ikatan ionik terbentuk, elektron (s) disumbangkan oleh logam dan elektron yang disumbangkan diterima oleh bukan logam. Mereka membentuk ikatan yang kuat kerana tarikan elektrostatik. Bon kovalen dibentuk di antara dua bukan logam. Dalam ikatan kovalen, dua atau lebih atom berkongsi elektron untuk memenuhi peraturan oktet. Umumnya, ikatan ionik lebih kuat daripada ikatan kovalen. Ini membawa kepada perbezaan dalam sifat fizikal mereka.
Apakah sebatian ionik?
Ikatan ionik dibentuk apabila dua atom mempunyai perbezaan besar dalam nilai elektronegativiti mereka. Dalam proses pembentukan ikatan, elektron atom elektron yang kurang elektron dan lebih banyak atom elektronegatif memperoleh elektron (s). Oleh itu, spesies yang dihasilkan adalah ion yang bertentangan dan mereka membentuk ikatan kerana tarikan elektrostatik yang kuat.
Bon ionik terbentuk antara logam dan bukan logam. Secara umum, logam tidak mempunyai banyak elektron valensi di shell paling luar; Walau bagaimanapun, bukan logam lebih dekat dengan lapan elektron dalam shell valence. Oleh itu, bukan logam cenderung menerima elektron untuk memenuhi peraturan oktet.
Contoh kompaun ionik adalah na+ + Cl- à naCl
Natrium (logam) hanya mempunyai satu elektron valensi dan klorin (bukan logam) mempunyai tujuh elektron valensi. 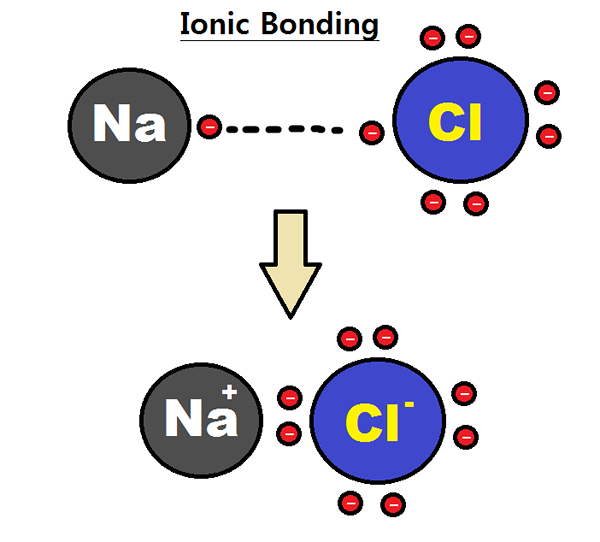
Apa itu sebatian kovalen?
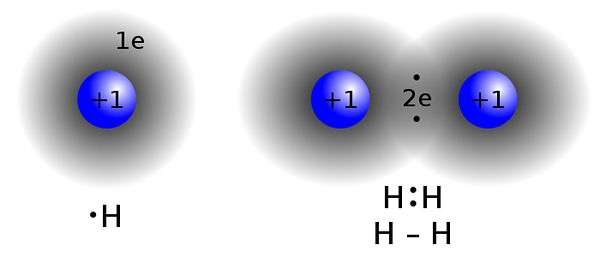
Sebatian kovalen dibentuk dengan berkongsi elektron antara dua atau lebih atom untuk memenuhi "peraturan oktet". Jenis ikatan ini biasanya dijumpai dalam sebatian bukan logam, atom dari kompaun yang sama atau unsur-unsur berdekatan dalam jadual berkala.Dua atom yang mempunyai nilai elektronegativiti hampir sama tidak bertukar (menderma / menerima) elektron dari shell valence mereka. Sebaliknya, mereka berkongsi elektron untuk mencapai konfigurasi oktet.
Contoh sebatian kovalen adalah metana (ch4), Karbon monoksida (CO), monobromida iodin (IBR)

Ikatan kovalen
Apakah perbezaan antara sebatian ionik dan kovalen?
Definisi sebatian ionik dan sebatian kovalen
Sebatian ionik: Kompaun ionik adalah sebatian kimia kation dan anion yang dipegang bersama oleh ikatan ionik dalam struktur kekisi.
Kompaun kovalen: Kompaun kovalen adalah ikatan kimia yang dibentuk oleh perkongsian satu atau lebih elektron, terutama pasang elektron, antara atom.
Sifat -sifat sebatian ionik dan kovalen
Ciri-ciri fizikal
Sebatian ionik:
Semua sebatian ionik wujud sebagai pepejal pada suhu bilik.
Sebatian ionik mempunyai struktur kristal yang stabil. Oleh itu, mereka mempunyai titik lebur yang lebih tinggi dan titik mendidih. Daya tarikan antara ion positif dan negatif sangat kuat.
| Sebatian ionik | Penampilan | Takat lebur |
| NaCl - natrium klorida | Pepejal kristal putih | 801 ° C |
| KCL - Potassium Chloride | Kristal vitreous putih atau tidak berwarna | 770 ° C |
| Mgcl2- Magnesium klorida | Pepejal kristal putih atau tidak berwarna | 1412 ° C |
Sebatian kovalen:
Sebatian kovalen wujud dalam ketiga -tiga bentuk; Sebagai pepejal, cecair dan gas pada suhu bilik.
Titik lebur dan mendidih mereka agak rendah berbanding dengan sebatian ionik.
| Kompaun kovalen | Penampilan | Takat lebur |
| Hcl-hydrogen chloride | Gas tidak berwarna | -114.2 ° C |
| Ch4 -Metana | Gas tidak berwarna | -182 ° C |
| CCL4 - Karbon tetrachloride | Cecair tanpa warna | -23 ° C |
Kekonduksian
Sebatian ionik: Sebatian ionik pepejal tidak mempunyai elektron percuma; Oleh itu, mereka tidak menjalankan elektrik dalam bentuk pepejal. Tetapi, apabila sebatian ionik dibubarkan di dalam air, mereka membuat penyelesaian yang menjalankan elektrik. Dengan kata lain, penyelesaian akueus sebatian ionik adalah konduktor elektrik yang baik.
Sebatian kovalen: Sebatian kovalen murni atau bentuk terlarut di dalam air tidak menjalankan elektrik. Oleh itu, sebatian kovalen adalah konduktor elektrik yang lemah dalam semua fasa.
Kelarutan
Sebatian ionik: Sebilangan besar sebatian ionik larut dalam air, tetapi mereka tidak larut dalam pelarut bukan kutub.
Sebatian kovalen: Sebilangan besar sebatian kovalen larut dalam pelarut bukan polar, tetapi tidak di dalam air.
Kekerasan
Sebatian ionik: Pepejal ionik lebih sukar dan rapuh.
Sebatian kovalen: Umumnya, sebatian kovalen lebih lembut daripada pepejal ionik.
Imej ihsan: "Hidrogen Bond Covalent" oleh Jacek FH - Kerja Sendiri. (CC BY-SA 3.0) melalui Commons "ionicbondingrh11" oleh rhannosh - kerja sendiri. (CC BY-SA 3.0) melalui Wikimedia Commons

