Perbezaan antara ion dipole dan dipole dipole

Perbezaan utama - ion dipole vs Dipole Kuasa dipole
Daya intermolecular adalah daya tarikan yang wujud antara molekul yang berbeza. Pasukan Ion-dipole dan daya dipole-dipole adalah dua bentuk daya intermolecular. Beberapa contoh lain untuk daya intermolecular termasuk kuasa dipole yang disebabkan oleh ion, ikatan hidrogen, dan pasukan van der Waal. Kekuatan ini adalah tarikan elektrostatik kerana molekul tertarik berdasarkan caj elektrik mereka. The Perbezaan utama Antara kuasa ion-dipole dan dipole-dipole adalah bahawa Kekuatan ion-dipole wujud antara spesies ionik dan molekul kutub manakala daya dipole-dipole wujud antara molekul kutub.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah kuasa dipol ion
3. Apakah kuasa dipole dipole
4. Persamaan antara ion dipole dan dipole dipole
5. Perbandingan sampingan - ion dipole vs dipole dipole dalam bentuk jadual
6. Ringkasan
Apakah kuasa dipol ion?
Daya ion-dipole adalah daya tarikan antara spesies ionik dan molekul kutub.Spesies ionik boleh menjadi anion (spesies yang dikenakan negatif) atau kation (spesies yang dikenakan positif).Molekul kutub adalah sebarang molekul yang mempunyai pemisahan cas elektrik kekal dalam molekul kerana perbezaan antara nilai elektronegativiti atom dalam molekul tersebut. Elektronegativiti adalah keupayaan untuk menarik elektron. Apabila atom yang mempunyai elektronegativiti yang tinggi terikat kepada atom yang mempunyai elektronegativiti yang rendah, elektron ikatan tertarik oleh atom yang mempunyai elektronegativiti yang tinggi (maka ia mendapat caj negatif separa), memberikan atom elektronegatif yang kurang. Pemisahan caj ini dipanggil polarisasi dan molekul dipanggil molekul kutub.
Daya ion-dipole lebih kuat daripada daya dipole-dipole. Ini kerana jenis daya intermolecular ini melibatkan spesies ionik yang mempunyai cas elektrik yang lebih tinggi berbanding dengan molekul kutub. Daya ion-dipole lebih kuat daripada ikatan hidrogen. Interaksi ini berlaku disebabkan oleh interaksi elektrostatik antara ion dan dipole.
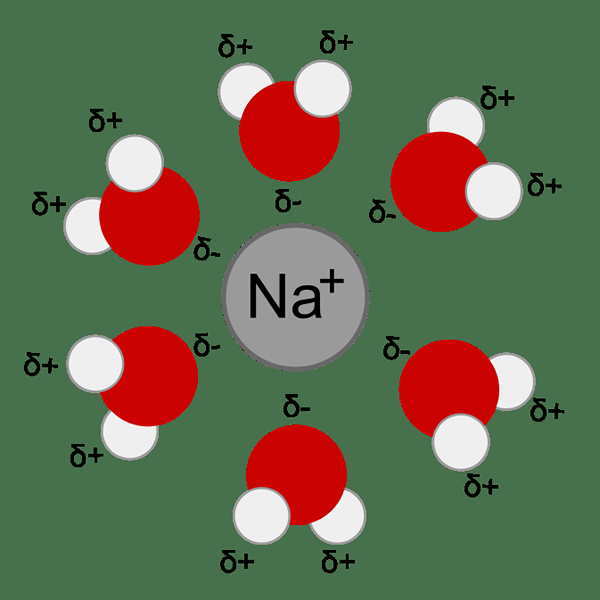
Rajah 01: Penghidratan ion logam berlaku kerana tarikan antara ion logam dan molekul air (dipole)
Subkategori daya ion-dipole adalah daya dipol yang disebabkan oleh ion yang melibatkan molekul nonpolar dan bukannya molekul kutub. Molekul nonpolar tidak mempunyai dipole (tiada pemisahan caj). Tuduhan ion menyebabkan molekul nonpolar mendapat polarisasi dengan memutarbelitkan awan elektron molekul nonpolar.
Apakah kuasa dipole dipole?
Daya dipole-dipole adalah daya intermolecular yang berlaku di antara molekul kutub. Ini adalah kuasa elektrostatik. Apabila membentuk jenis kuasa ini, molekul kutub cenderung diselaraskan supaya tarikan antara molekul dimaksimumkan dengan mengurangkan potensi tenaga. Penjajaran ini juga mengurangkan penolakan antara molekul.

Rajah 02: Daya tarikan antara molekul polar HCl
Apabila satu siri sebatian dengan massa molar yang sama dipertimbangkan (yang mempunyai daya interaksi dipole-dipole antara molekul) kekuatan daya dipole-dipole meningkat apabila polaritas meningkat. Itu berlaku kerana apabila polariti tinggi, ini bermakna pemisahan caj tinggi. Apabila molekul mempunyai pemisahan caj yang tinggi (terminal positif dan negatif yang tinggi dalam molekul yang sama), ia cenderung menarik caj yang bertentangan. Ini juga membawa kepada peningkatan titik sebatian mendidih. Lebih besar daya dipole-dipole, lebih besar titik mendidih.
Apakah persamaan antara ion dipole dan dipole dipole?
- Kedua -dua ion dipol dan dipole dipole adalah jenis interaksi intermolecular
- Kedua -dua kuasa dipole dan dipole dipole adalah kuasa elektrostatik
Apakah perbezaan antara ion dipole dan dipole dipole?
Ion dipole vs dipole dipole | |
| Daya dipol ion adalah daya menarik antara spesies ionik dan molekul kutub. | Daya dipole-dipole adalah daya intermolecular yang berlaku di antara molekul kutub. |
| Kekuatan | |
| Daya ion-dipole lebih kuat daripada ikatan hidrogen dan daya dipole-dipole. | Daya dipole-dipole lebih lemah daripada ikatan hidrogen dan kuasa ion-dipole. |
| Komponen | |
| Daya ion-dipole timbul antara ion (kation atau anion) dan molekul kutub. | Daya dipole-dipole timbul antara molekul kutub. |
Ringkasan - Ion dipole vs Dipole Kuasa dipole
Daya ion-dipole dan daya dipole-dipole adalah daya intermolecular yang wujud antara spesies kimia yang berlainan seperti kation, anion, dan molekul kutub. Molekul Polar adalah sebatian kovalen yang mempunyai dipoles (pemisahan caj elektrik). Molekul kutub mempunyai terminal yang dikenakan positif dan terminal yang dikenakan secara negatif dalam molekul yang sama. Oleh itu, terminal ini boleh mempunyai tarikan elektrostatik dengan caj yang bertentangan. Perbezaan antara daya ion-dipole dan dipole-dipole ialah daya ion-dipole wujud antara spesies ionik dan molekul kutub manakala daya dipole-dipole wujud antara molekul kutub.
Rujukan:
1."11.3: Dipole-dipole kuasa."Kimia Libretexts, Libretexts, 11 Feb. 2018. Terdapat di sini
2.Kuasa dipole-dipole. Terdapat di sini
3."Daya Intermolecular."Wikipedia, Yayasan Wikimedia, 14 Mar. 2018. Terdapat di sini
Ihsan gambar:
1.'Na+H2O'By Taxman (Domain Awam) melalui Commons Wikimedia
2.'Dipole-dipole-Interaction-in-Hcl-2d'by Benjah-Bmm27-Kerja sendiri, (Domain Awam) melalui Commons Wikimedia


