Perbezaan antara iodin dan kalium iodida

The Perbezaan utama Antara iodin dan kalium iodida ialah Iodin adalah elemen kimia manakala kalium iodida adalah sebatian kimia.
Iodin adalah halogen yang terletak dalam kumpulan 17 dari jadual berkala elemen. Sebaliknya, kalium iodida adalah sebatian kimia yang terbentuk dari gabungan iodin dan kalium. Akibatnya, kalium iodida sangat berguna dalam banyak industri sebagai sumber iodin.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Iodin
3. Apa itu kalium iodida
4. Perbandingan sampingan - iodin vs kalium iodida dalam bentuk jadual
5. Ringkasan
Apa itu Iodin?
Iodin adalah elemen kimia yang mempunyai nombor atom 53 dan simbol kimia i. Ia adalah halogen paling berat di kalangan halogen yang lain. Halogen adalah kumpulan 17 elemen kimia dalam jadual berkala. Tambahan pula, iodin wujud sebagai pepejal kelabu yang berkilau pada suhu bilik. Walau bagaimanapun, ia dapat dengan mudah menjalani sublimasi untuk membentuk gas violet yodium. Selain itu, di antara pengoksidaan menyatakan bahawa iodin boleh wujud, pengoksidaan -1 adalah yang paling biasa di kalangan mereka, yang menghasilkan anion iodida. Ini kerana, iodin mempunyai oktet yang tidak lengkap dalam konfigurasi elektron di mana ia memerlukan elektron untuk menyelesaikan oktet. Kemudian, apabila ia memperoleh elektron dari luar, ia membentuk keadaan pengoksidaan -1.
Beberapa fakta penting mengenai iodin adalah seperti berikut:
- Nombor atom - 53
- Berat atom standard - 126.9
- Penampilan - pepejal kelabu yang berkilau, metalik
- Konfigurasi Elektron - [KR] 4D10 5s2 5p5
- Kumpulan - 17
- Tempoh - 5
- Kategori Kimia - Bukan Metal
- Titik lebur ialah 113.7 ° C
- Titik mendidih ialah 184.3 ° C

Rajah 01: Sampel yodin pepejal
Selain itu, iodin adalah pengoksida yang kuat. Terutamanya, ia disebabkan oleh oktet elektron yang tidak lengkap di mana ia tidak mempunyai satu elektron untuk mengisi orbital P. Oleh itu, ia mencari elektron dengan mengoksidakan spesies kimia lain. Walau bagaimanapun, ia adalah ejen pengoksidaan yang paling lemah di kalangan halogen lain kerana saiz atomnya yang besar.
Apa itu kalium iodida?
Potassium Iodide adalah sebatian bukan organik dan muncul sebagai pepejal putih dan dihasilkan secara komersil dalam kuantiti yang banyak. Ia adalah sebatian iodida yang paling penting kerana ia kurang hygroscopic daripada sebatian iodida lain. Formula kimia sebatian ini adalah ki.
Beberapa fakta kimia penting mengenai sebatian ini adalah seperti berikut:
- Formula kimia - ki
- Molar Massa - 166 g/mol.
- Titik lebur ialah 681 ° C.
- Titik mendidih ialah 1,330 ° C.
- Ia mempunyai struktur kristal natrium klorida.
- Ejen pengurangan ringan.
- Pengeluaran secara industri dengan merawat KOH dengan iodin.

Rajah 02: Sampel iodida kalium pepejal
Permohonan Ki yang paling penting adalah dalam bentuk SSKI (penyelesaian tepu kalium iodida juga) tablet. Tablet ini diambil dalam rawatan kecemasan beberapa penyakit. Juga, SSKI berguna untuk rawatan dalam kes pendedahan kepada kemalangan nuklear. Tambahan pula, Ki adalah suplemen untuk kekurangan iodin apabila ditambah ke garam meja. Selain itu, kita boleh menggunakannya dalam industri fotografi dan dalam bidang penyelidikan bioperubatan.
Apakah perbezaan antara iodin dan kalium iodida?
Iodin adalah elemen kimia yang mempunyai nombor atom 53 dan simbol kimia i sedangkan kalium iodida adalah sebatian bukan organik dan muncul sebagai pepejal putih dan dihasilkan secara komersil dalam kuantiti yang banyak. Oleh itu, perbezaan utama antara iodin dan kalium iodida ialah yodium adalah elemen kimia manakala kalium iodida adalah sebatian kimia. Ringkasnya, yodium menggabungkan dengan kalium (e.g., Koh) untuk menghasilkan sebatian kalium iodida. Sebagai satu lagi perbezaan penting antara iodin dan kalium iodida, kita boleh mengatakan bahawa iodin mempunyai penampilan yang berkilau, kelabu-kelabu manakala kalium iodida muncul sebagai sebatian pepejal putih.
Selain itu, terdapat perbezaan antara iodin dan kalium iodida dalam penggunaannya juga. Juga, terdapat beberapa perbezaan lain dalam sifat kimia mereka juga. Infographic di bawah meringkaskan perbezaan antara iodin dan kalium iodida dalam bentuk jadual.
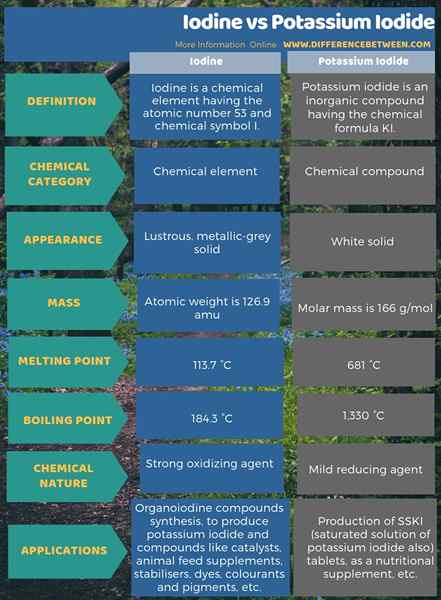
Ringkasan -iodin vs kalium iodida
Iodin menjadi halogen tidak boleh kekal sebagai elemen di bawah suhu dan tekanan standard tetapi menggabungkan dengan unsur -unsur lain untuk membentuk sebatian dengan mudah. Oleh itu, harta benda ini membentuk sebatian yang menjadikannya elemen yang sangat penting. Oleh itu, perbezaan utama antara iodin dan kalium iodida ialah yodium adalah elemen kimia manakala kalium iodida adalah sebatian kimia. Iodin menggabungkan dengan kalium untuk membentuk kalium iodida yang merupakan sebatian yang sangat penting yang berguna secara komersial dalam pelbagai industri. Walau bagaimanapun, isotop iodin berbahaya bagi manusia, tetapi apabila iodin ini diambil dalam bentuk ki, ia menjadi berguna kepada manusia. Selain itu, kekurangan iodin membawa kepada keterlambatan mental dan goitre, kekurangan ini dipenuhi oleh pentadbiran yodium dalam bentuk ki.
Rujukan:
1."Iodin."Wikipedia, Yayasan Wikimedia, 20 Okt. 2018. Terdapat di sini
2."Potassium iodide."Wikipedia, Yayasan Wikimedia, 26 Sept. 2018. Terdapat di sini
Ihsan gambar:
1."Sampel iodin" oleh LHCHEM - Kerja sendiri, (CC BY -SA 3.0) melalui Commons Wikimedia
2."Potassium Iodide" (Domain Awam) melalui Commons Wikimedia


