Perbezaan antara dipole dan dipole tetap yang disebabkan
The Perbezaan utama antara dipole dan dipole tetap yang diinduksi ialah Momen dipole yang disebabkan dapat berubah apabila faktor -faktor yang mempengaruhi momen dipole berubah, sedangkan perubahan faktor luaran tidak mempengaruhi momen dipole tetap.
Daya intermolecular adalah interaksi antara molekul. Interaksi ini mungkin termasuk tarikan dan penolakan. Daya intermolecular yang menarik menyebabkan pembentukan sebatian seperti kristal. Daya intermolecular yang paling biasa menarik termasuk ikatan hidrogen, ikatan ionik, interaksi dipole yang disebabkan oleh ion, interaksi dipole permanen ion, dan daya van der Waal.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa yang disebabkan dipole
3. Apa itu dipole tetap
4. Perbandingan sampingan - Dipole vs dipole tetap dalam bentuk jadual
5. Ringkasan
Apa yang disebabkan dipole?
Dipole yang disebabkan merujuk kepada momen dipole yang dibuat dalam sebatian nonpolar kerana kesan ion berdekatan. Di sini, sebatian ion dan nonpolar membentuk interaksi yang disebut interaksi dipole yang disebabkan oleh ion. Tuduhan ion menginduksi penciptaan dipole (spesies kimia dengan polarisasi). Di samping itu, ion dapat menangkis awan elektron sebatian nonpolar dengan semakin dekat dengan sebatian nonpolar.
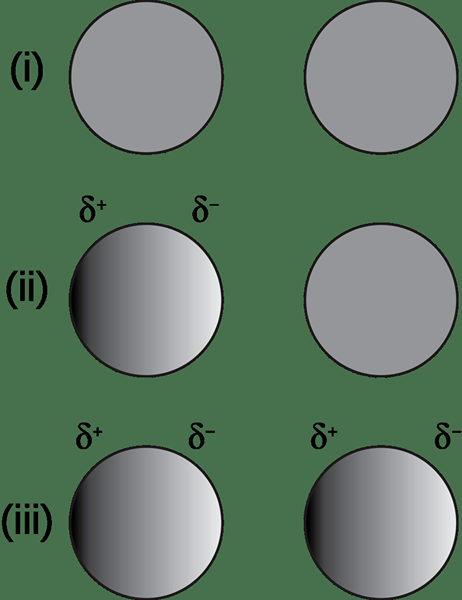
Rajah 01: Pembentukan dipole yang disebabkan oleh kehadiran spesies yang dikenakan
Kedua -dua ion yang dikenakan negatif dan positif boleh menyebabkan momen -momen dipole ini. Contohnya, mari kita ambil ion yang dikenakan negatif yang mendorong momen dipole di sebatian nonpolar. Bahagian sebatian nonpolar yang lebih dekat dengan ion mendapat caj positif separa kerana awan elektron ditolak oleh elektron negatif ion. Ini, seterusnya, memberikan sisi lain dari sebatian nonpolar sebagai caj negatif separa. Oleh itu, dipole yang diinduksi dicipta di sebatian nonpolar.
Begitu juga, ion caj positif menarik awan elektron, memberikan caj negatif separa ke sisi sebatian nonpolar yang lebih dekat dengan ion positif.
Apa itu dipole tetap?
Dipole tetap merujuk kepada momen dipole yang pada asalnya berlaku dalam sebatian kerana pengedaran elektron yang tidak rata. Oleh itu, sebatian kutub mengandungi momen dipole tetap.

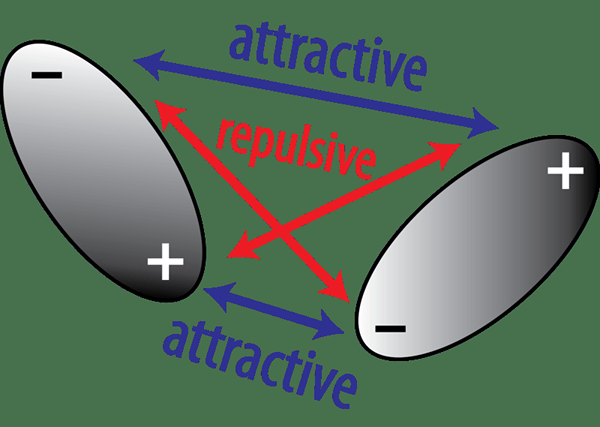
Rajah 02: Tarikan dan penolakan antara dipole tetap
Di sini, sebatian kutub mengandungi dua atom yang berbeza dengan nilai elektronegativiti yang berbeza. Oleh sebab itu, lebih banyak atom elektronegatif dalam sebatian kutub menarik elektron ikatan daripada kurang atom elektronegatif. Ini mewujudkan keadaan di mana atom elektronegatif yang lebih banyak mendapat caj negatif separa manakala atom elektronegatif yang kurang mendapat caj positif separa. Ini menetapkan dipole tetap dalam molekul.
Apakah perbezaan antara dipole dan dipole tetap yang disebabkan?
Dipole yang diinduksi merujuk kepada momen dipole yang dibuat dalam sebatian nonpolar kerana kesan ion berdekatan. Sebaliknya, dipole tetap merujuk kepada momen dipole yang pada asalnya berlaku dalam sebatian kerana pengedaran elektron yang tidak sekata. Selain itu, diploe yang disebabkan berlaku dalam sebatian nonpolar, sementara dipole tetap berlaku dalam sebatian kutub. Oleh itu, perbezaan utama antara dipole dan dipole tetap yang disebabkan oleh momen dipole yang disebabkan dapat berubah apabila faktor -faktor yang mempengaruhi momen dipole berubah manakala perubahan faktor luaran tidak mempengaruhi momen dipole kekal.
Infographic di bawah ini membezakan perbezaan antara dipole dan dipole tetap yang diinduksi.
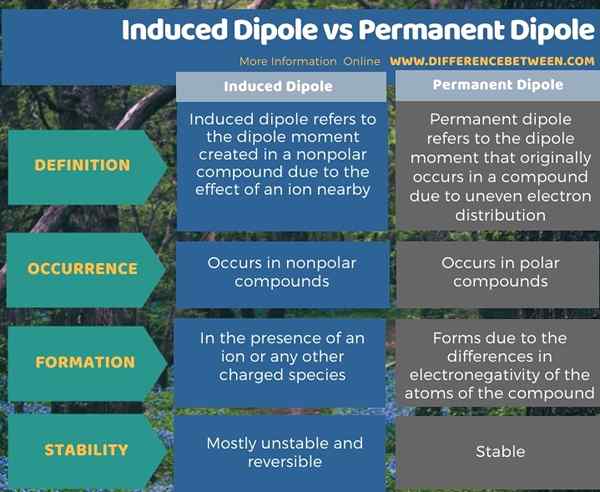
Ringkasan -dipole vs dipole tetap
Dipole yang diinduksi merujuk kepada momen dipole yang dibuat dalam sebatian nonpolar kerana kesan ion berdekatan. Sebaliknya, dipole tetap merujuk kepada momen dipole yang pada asalnya berlaku dalam sebatian kerana pengedaran elektron yang tidak sekata. Oleh itu, perbezaan utama antara dipole dan dipole kekal adalah momen dipole yang disebabkan dapat berubah apabila faktor -faktor yang mempengaruhi momen dipole berubah, sedangkan perubahan faktor luaran tidak mempengaruhi momen dipole tetap.
Rujukan:
1."Interaksi dipole ion -."Kimia Libreetexts, Libretexts, 5 Jun 2019, boleh didapati di sini.
2. "Daya Intermolecular."Wikipedia, Yayasan Wikimedia, 29 Jan. 2020, boleh didapati di sini.
Ihsan gambar:
1. "Skematik interaksi-dipole-interaksi yang disebabkan oleh dipole" oleh Christopher Rowley-Kerja Sendiri (CC BY-SA 4.0) melalui Commons Wikimedia
2. "Skema interaksi elektrostatik antara dua molekul dipolar" oleh CNROWLEY - Kerja sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


