Perbezaan antara undang -undang gas ideal dan undang -undang gas sebenar
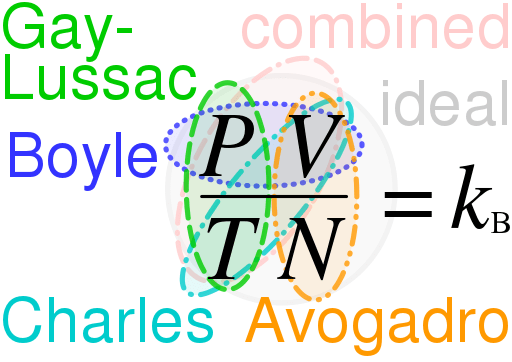
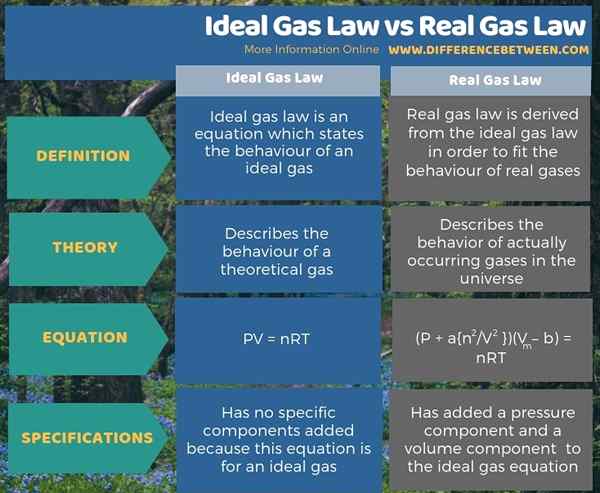
The Perbezaan utama antara undang -undang gas ideal dan undang -undang gas sebenar ialah Undang -undang gas ideal menerangkan tingkah laku gas teoritis, sedangkan undang -undang gas sebenar menggambarkan tingkah laku gas yang sebenarnya berlaku di alam semesta.
Gas yang ideal adalah gas teoritis yang zarah gas yang bergerak secara rawak mempunyai perlanggaran elastik sepenuhnya dan tidak ada interaksi lain di antara mereka. Menurut definisi ini, kita dapat memahami bahawa gas -gas ideal ini tidak dapat berlaku di alam semulajadi kerana terdapat interaksi antara zarah gas untuk mana -mana gas yang kita tahu. Malah, gas yang kita tahu adalah gas sebenar.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Undang -undang Gas Ideal
3. Apa itu undang -undang gas sebenar
4. Perbandingan sampingan - Undang -undang gas ideal vs undang -undang gas sebenar dalam bentuk jadual
5. Ringkasan
Apakah undang -undang gas yang ideal?
Undang -undang Gas Ideal adalah persamaan yang menggambarkan tingkah laku gas yang ideal. Gas ideal adalah hipotesis, dan gas ini hanya berlaku dalam teori. Oleh itu, menggunakan undang -undang gas yang ideal, kita dapat memahami dan menganggarkan tingkah laku banyak gas sebenar yang kita tahu. Walau bagaimanapun, ia mempunyai beberapa batasan. Juga, undang -undang ini adalah gabungan beberapa undang -undang lain:
- Undang -undang Boyle
- Undang -undang Charles
- Undang -undang Avogadro
- Undang-undang Gay-Lussac
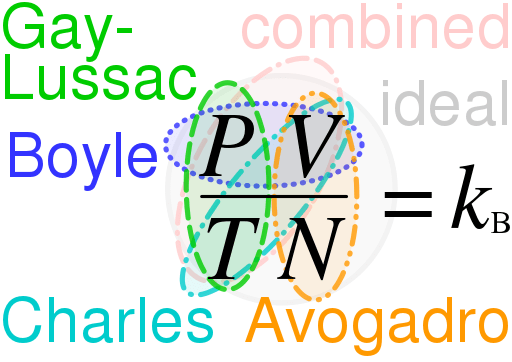
Pengiraan
Pada asasnya, kita boleh memberikan undang -undang gas yang ideal seperti berikut;
Pv = nrt
Di mana, p adalah tekanan, v adalah isipadu dan t adalah suhu gas ideal. Di sini, "n" adalah bilangan tahi lalat gas ideal dan "r" adalah malar - kami memanggilnya pemalar gas yang ideal. Ia mempunyai nilai sejagat; Nilai r adalah sama untuk mana -mana gas, dan ia adalah 8.314 j/(k · mol).
Selain itu, kita boleh mendapatkan derivatif yang berbeza dari undang -undang ini; bentuk molar, bentuk gabungan, dll. Sebagai contoh, kerana "n" adalah bilangan tahi lalat, kita dapat memberikannya menggunakan berat molekul gas. Terbitan adalah seperti berikut.
n = m/m
di mana, n adalah bilangan tahi lalat gas, m adalah jisim gas dan m adalah berat molekul gas. Dengan menggunakan persamaan di atas,
Pv = nrt
Pv = (m/m) rt
Jika kita ingin mendapatkan ketumpatan gas, kita boleh menggunakan persamaan di atas seperti berikut;
P = (m/vm) rt
P = ρrt/m
Lebih -lebih lagi, jika kita ingin mendapatkan undang -undang gas gabungan dari undang -undang gas yang ideal, kita dapat memperolehnya seperti berikut; Untuk dua gas "1" dan "2", tekanan, kelantangan dan suhu adalah p1,V1,T1 dan p2, V2 dan t2. Kemudian untuk kedua -dua gas, kita boleh menulis dua persamaan sebagai;
P1V1 = Nrt1... (1)
P2V2 = Nrt2 ... (2)
Dengan membahagikan persamaan (1) dari persamaan (2), kita dapat,
(Ms1V1)/(P2V2) = T1/ T2
Kita boleh menyusun semula persamaan ini seperti berikut;
P1V1/ T1 = P2V2/ T2
Apa itu undang -undang gas sebenar?
Undang -undang gas sebenar, juga dipanggil Undang -undang Van der Waals, berasal dari undang -undang gas yang ideal untuk menggambarkan tingkah laku gas sebenar. Oleh kerana gas sebenar tidak dapat berkelakuan ideal, undang -undang gas sebenar telah membuat perubahan kepada komponen tekanan dan kelantangan dalam undang -undang gas ideal. Oleh itu, kita boleh mendapatkan kelantangan dan tekanan seperti berikut:
Kelantangan gas sebenar = (vm - b)
Tekanan gas sebenar = (p + a n2/V2)
Kemudian, kita boleh mendapatkan undang -undang gas sebenar dengan menggunakan komponen yang diubah suai ini kepada undang -undang gas yang ideal seperti berikut:
(P + a n2/V2) (Vm - b) = NRT
Di mana, vm adalah jumlah molar gas, r adalah pemalar gas sejagat, t adalah suhu gas sebenar, p adalah tekanan.
Apakah perbezaan antara undang -undang gas ideal dan undang -undang gas sebenar?
Undang -undang Gas Ideal adalah persamaan yang menggambarkan tingkah laku gas yang ideal. Undang -undang gas sebenar berasal dari undang -undang gas yang ideal untuk memenuhi tingkah laku gas sebenar. Oleh itu, perbezaan utama antara undang -undang gas ideal dan undang -undang gas sebenar ialah undang -undang gas ideal menggambarkan tingkah laku gas teoritis, sedangkan undang -undang gas sebenar menggambarkan tingkah laku gas yang sebenarnya berlaku di alam semesta.
Selain itu, kita dapat memperoleh undang -undang gas yang ideal dari persamaan PV = NRT, dan undang -undang gas sebenar dari persamaan (p + a n2/V2) (Vm - b) = NRT.
Ringkasan -Undang -undang Gas Ideal vs Undang -undang Gas Sebenar
Ringkasnya, gas yang ideal adalah bahan hipotesis yang mempunyai perlanggaran elastik sepenuhnya antara zarah gas, harta yang paling gas sebenar yang kita tahu tidak ditunjukkan. Perbezaan utama antara undang -undang gas ideal dan undang -undang gas sebenar ialah undang -undang gas ideal menggambarkan tingkah laku gas teoritis, sedangkan undang -undang gas sebenar menggambarkan tingkah laku gas yang sebenarnya berlaku di alam semesta.
Rujukan:
1. Undang -undang Gas Ideal, Hyperphysics. Georgia State University, boleh didapati di sini.
Ihsan gambar:
1. "Hubungan Undang -undang Gas Ideal" oleh Cmglee - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia
2. "Undang -undang Gas Ideal" oleh Blyumj - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia