Perbezaan antara hibridisasi dan tumpang tindih
The Perbezaan utama antara hibridisasi dan pertindihan adalah bahawa Hibridisasi merujuk kepada pembentukan orbital hibrid baru melalui tumpang tindih orbital atom, sedangkan bertindih merujuk kepada pencampuran orbital atom.
Orbital adalah struktur hipotesis yang boleh diisi dengan elektron. Menurut penemuan yang berbeza, saintis mencadangkan bentuk yang berbeza untuk orbital ini. Terdapat tiga jenis orbital utama: orbital atom, orbital molekul, dan orbital hibrid. Orbital hibrid terbentuk melalui proses hibridisasi. Hibridisasi dan pertindihan adalah dua konsep kimia yang berkaitan. Tumpang tindih orbital atom berlaku semasa hibridisasi.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah hibridisasi
3. Apa yang bertindih
4. Perbandingan sampingan - Hibridisasi vs bertindih dalam bentuk jadual
5. Ringkasan
Apakah hibridisasi?
Hibridisasi adalah proses kimia di mana orbital hibrid terbentuk dari pencampuran orbital atom. Teori hibridisasi adalah teknik yang kita gunakan untuk menggambarkan struktur orbit molekul. Pada asasnya, hibridisasi adalah pembentukan orbital hibrid dengan mencampurkan dua atau lebih orbital atom. Orientasi orbital ini menentukan geometri molekul. Ini adalah pengembangan teori ikatan valensi.
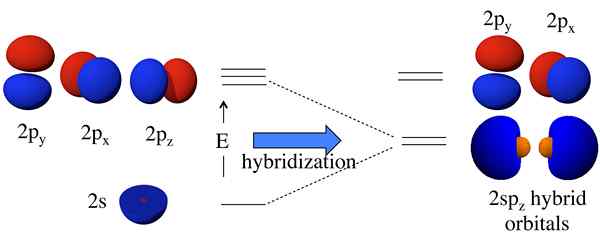
Sebelum pembentukan orbital atom, mereka mempunyai tenaga yang berbeza, tetapi selepas pembentukan, semua orbital mempunyai tenaga yang sama. Sebagai contoh, orbital atom S, dan orbital atom P boleh bergabung untuk membentuk dua orbital SP. Orbital atom S dan P mempunyai tenaga yang berbeza (tenaga S < energy of p). But, after hybridization, it forms two sp orbitals which have the same energy, and this energy lies between the energies of individual s and p atomic orbital energies. Moreover, this sp hybrid orbital has 50% s orbital characteristics and 50% p orbital characteristics.

Rajah 01: Pembentukan orbital hibrid
Idea hibridisasi pertama kali masuk ke dalam perbincangan kerana sejak teori ikatan valensi gagal meramalkan struktur beberapa molekul seperti ch4. Walaupun atom karbon di ch4 hanya mempunyai dua elektron yang tidak berpasangan mengikut konfigurasi elektron, ia boleh membentuk empat ikatan kovalen. Untuk membentuk empat bon, mesti ada empat elektron yang tidak berpasangan.
Satu -satunya cara untuk menerangkan fenomena ini adalah untuk berfikir bahawa S dan P orbitals fius atom karbon antara satu sama lain untuk membentuk orbital baru yang dipanggil orbital hibrid yang mempunyai tenaga yang sama. Di sini, satu s + tiga p memberikan 4 sp3 orbital. Oleh itu, elektron mengisi orbital hibrid ini secara merata (satu elektron per orbital hibrid), mematuhi peraturan hund. Oleh itu, terdapat empat elektron untuk pembentukan empat ikatan kovalen dengan empat atom hidrogen.
Apa yang bertindih?
Bertindih adalah proses kimia di mana orbital atom bertindih antara satu sama lain. Dalam erti kata lain, ia adalah kepekatan orbital dalam ruang antara atom yang berbeza, yang membawa kepada pembentukan ikatan kimia. Linus Pauling mula -mula membangunkan teori mengenai tumpang tindih orbital ini. Dia menjelaskan sudut ikatan molekul dalam molekul yang berbeza, dan konsep ini menjadi asas untuk teori hibridisasi.
Apakah perbezaan antara hibridisasi dan tumpang tindih?
Hibridisasi dan pertindihan adalah dua konsep kimia yang berkaitan. Perbezaan utama antara hibridisasi dan tumpang tindih ialah hibridisasi adalah pembentukan orbital hibrid baru melalui tumpang tindih orbital atom, sedangkan tumpang tindih adalah pencampuran orbital atom. Tambahan pula, dalam proses hibridisasi, orbital atom yang sama bertindih untuk membentuk orbital hibrid semasa dalam proses bertindih, orbital atom yang sama bertindih untuk membentuk orbital hibrid dan orbital atom yang berbeza bertindih untuk membentuk ikatan kimia.
Infographic di bawah membentangkan lebih banyak fakta mengenai perbezaan antara hibridisasi dan pertindihan.
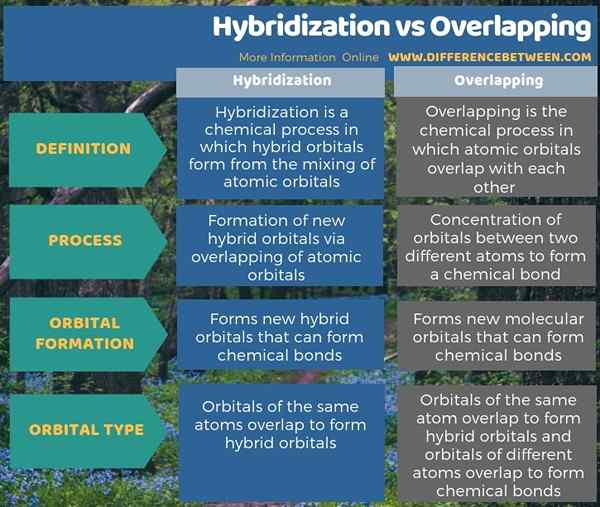
Ringkasan -Hibridisasi vs bertindih
Hibridisasi dan pertindihan adalah dua konsep kimia yang berkaitan. Ringkasnya, perbezaan utama antara hibridisasi dan pertindihan adalah bahawa hibridisasi merujuk kepada pembentukan orbital hibrid baru melalui tumpang tindih orbital atom, sedangkan tumpang tindih bermakna pencampuran orbital atom.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi orbit hibrid."Pemikiran, Jun. 22, 2018, boleh didapati di sini.
Ihsan gambar:
1. "SP Hibridisasi" oleh TEM5Psu - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia


