Perbezaan antara isomer geometri dan isomer struktur

Isomer geometri vs isomer struktur
Isomer adalah sebatian yang berbeza dengan formula molekul yang sama. Terdapat pelbagai jenis isomer. Isomer boleh dibahagikan kepada dua kumpulan sebagai isomer perlembagaan dan stereoisomer. Isomer perlembagaan adalah isomer di mana sambungan atom berbeza dalam molekul. Dalam atom stereoisomer disambungkan dalam urutan yang sama, tidak seperti isomer perlembagaan. Stereoisomer hanya berbeza dalam susunan atom mereka di ruang angkasa. Stereoisomer boleh terdiri daripada dua jenis, enantiomer dan diastereomer. Diastereomers adalah stereoisomer, yang molekulnya bukan cermin imej antara satu sama lain. Enantiomer adalah stereoisomer, yang molekulnya adalah imej cermin yang tidak dapat dipertahankan antara satu sama lain. Enantiomer hanya berlaku dengan molekul kiral. Molekul kiral ditakrifkan sebagai salah satu yang tidak sama dengan imej cerminnya. Oleh itu, molekul kiral dan imej cerminnya adalah enantiomer antara satu sama lain. Sebagai contoh, molekul 2-butanol adalah kiral, dan imej cerminnya adalah enantiomer.
Isomer geometri
Isomer geometri adalah jenis stereoisomer. Keputusan isomer jenis ini, apabila molekul mempunyai putaran terhad, pada dasarnya, disebabkan oleh ikatan berganda. Apabila terdapat satu karbon - ikatan karbon, putarannya mungkin. Oleh itu, namun kita menarik atom, susunan mereka akan sama. Tetapi apabila terdapat karbon - ikatan ganda karbon, kita dapat menarik dua pengaturan atom dalam molekul. Isomer yang dihasilkan dikenali sebagai CIS, isomer trans atau isomer E-Z. Dalam isomer cis, jenis atom yang sama berada di sisi yang sama molekul. Tetapi dalam isomer trans, jenis atom yang sama berada di seberang molekul. Sebagai contoh, struktur cis dan trans untuk 1,2-dichloroethane adalah seperti berikut.
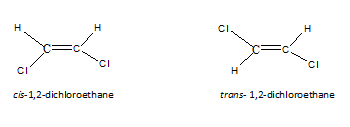
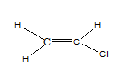
Untuk molekul mempunyai isomer geometri, bukan sahaja cukup untuk mempunyai ikatan berganda sahaja. Kedua -dua atom atau kumpulan yang dilampirkan pada satu hujung ikatan berganda harus berbeza. Sebagai contoh, berikutan molekul tidak mempunyai isomer geometri, kedua -dua atom di hujung kiri adalah hidrogen. Kerana itu, jika kita menariknya sama ada CIS atau trans, kedua -dua molekul adalah sama.
Tetapi tidak kira jika semua empat kumpulan atau atom yang dilampirkan berbeza. Pada masa itu, kita boleh menamakannya sebagai e atau z.
Isomer struktur
Ini juga dikenali sebagai isomer perlembagaan. Isomer perlembagaan adalah isomer, di mana sambungan atom berbeza dalam molekul. Butane adalah alkana yang paling mudah untuk menunjukkan isomerisme perlembagaan. Butane mempunyai dua isomer perlembagaan, butana sendiri dan isobutene.
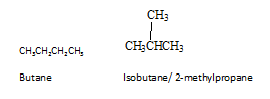
Oleh kerana sambungan mereka berbeza, dua molekul mempunyai sifat fizikal dan kimia yang berbeza. Isomer struktur boleh dibentuk oleh hidrokarbon di mana mereka mempunyai minimum empat atom karbon. Terdapat tiga jenis isomer struktur sebagai isomer kumpulan rangka, kedudukan dan berfungsi. Dalam isomerisme rangka, seperti yang diberikan dalam contoh di atas, rangka disusun semula untuk memberikan isomer yang berbeza. Dalam isomer kedudukan, kumpulan berfungsi atau kumpulan lain mengubah kedudukan. Dalam isomer kumpulan berfungsi, walaupun mereka mempunyai formula yang sama, molekul berbeza dengan mempunyai kumpulan fungsi yang berbeza.
| Apakah perbezaan antara Isomer geometri dan isomer struktur? • Isomer geometri adalah stereoisomer. Oleh itu, terdapat sambungan juga sama berbanding dengan isomer struktur, di mana isomer berbeza disebabkan oleh sambungan atom. Dalam isomer geometri, mereka berbeza kerana susunan tiga dimensi di ruang. • Selalunya untuk molekul terdapat dua isomer geometri sebagai cis, trans atau e, z, tetapi untuk molekul boleh ada sebilangan besar isomer struktur. • Isomerisme geometri pada dasarnya ditunjukkan oleh molekul dengan ikatan ganda karbon-karbon. Isomerisme struktur ditunjukkan oleh alkana, alkena, alkena dan sebatian aromatik, juga. |


