Perbezaan antara tenaga bebas dan tenaga pengaktifan
The Perbezaan utama antara tenaga bebas dan tenaga pengaktifan ialah Tenaga bebas adalah jumlah Tenaga yang tersedia untuk sistem termodinamik untuk melaksanakan kerja termodinamik, sedangkan tenaga pengaktifan tindak balas kimia adalah halangan tenaga yang harus diatasi untuk mendapatkan produk dari reaksi.
Tenaga dan tenaga pengaktifan bebas adalah dua istilah yang berbeza yang mempunyai aplikasi yang berbeza juga. Tenaga bebas istilah digunakan mengenai sistem termodinamik dalam kimia fizikal, sedangkan istilah tenaga pengaktifan digunakan terutamanya mengenai tindak balas kimia dalam biokimia.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Tenaga Percuma
3. Apakah Tenaga Pengaktifan
4. Perbandingan sampingan - Tenaga Tenaga Percuma vs Tenaga Pengaktifan dalam Bentuk Tabular
5. Ringkasan
Apa itu Tenaga Percuma?
Tenaga Percuma adalah jumlah tenaga yang tersedia untuk sistem termodinamik untuk melaksanakan kerja termodinamik. Tenaga bebas mempunyai dimensi tenaga. Nilai tenaga bebas sistem termodinamik ditentukan oleh keadaan sistem sekarang, bukan oleh sejarahnya. Terdapat dua jenis tenaga bebas utama yang sering dibincangkan dalam termodinamik: Helmholtz Free Energy dan Gibbs Free Energy.
Helmholtz Tenaga Percuma adalah tenaga yang terdapat dalam sistem termodinamik tertutup untuk melaksanakan kerja termodinamik pada suhu dan kelantangan malar. Oleh itu, nilai negatif tenaga helmholtz menunjukkan kerja maksimum yang dapat dilakukan oleh sistem termodinamik dengan memegang volumnya tetap. Untuk mengekalkan kelantangan volum, beberapa kerja termodinamik keseluruhan dilakukan sebagai kerja sempadan (untuk mengekalkan sempadan sistem seperti itu).
Gibbs Free Energy adalah tenaga yang terdapat dalam sistem termodinamik tertutup untuk melaksanakan kerja termodinamik pada suhu dan tekanan malar. Jumlah sistem boleh berbeza -beza. Tenaga bebas dilambangkan oleh g.
Apakah Tenaga Pengaktifan?
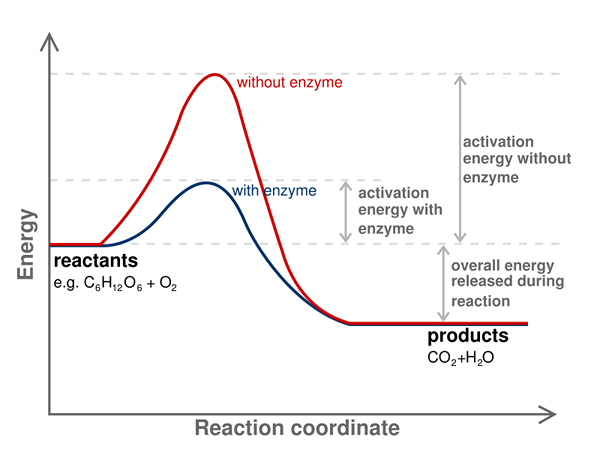
Tenaga pengaktifan tindak balas kimia adalah halangan tenaga yang harus diatasi untuk mendapatkan produk dari reaksi. Dengan kata lain, ia adalah tenaga minimum yang diperlukan untuk reaktan untuk ditukar menjadi produk. Selalu perlu menyediakan tenaga pengaktifan untuk memulakan tindak balas kimia.
Kami menunjukkan tenaga pengaktifan sebagai ea atau ae; Kami mengukurnya dengan unit kj/mol. Selain itu, tenaga pengaktifan dianggap sebagai tenaga minimum yang diperlukan untuk membentuk pertengahan dengan tenaga berpotensi tertinggi dalam reaksi kimia. Beberapa reaksi kimia mempunyai perkembangan yang perlahan dan berlaku melalui dua atau lebih langkah. Di sini, perantaraan dibentuk dan kemudian disusun semula untuk membentuk produk akhir. Oleh itu, tenaga yang diperlukan untuk memulakan tindak balas itu adalah tenaga yang diperlukan untuk membentuk pertengahan dengan tenaga berpotensi tertinggi.

Tambahan pula, pemangkin dapat mengurangkan tenaga pengaktifan. Oleh itu, pemangkin sering digunakan untuk mengatasi halangan tenaga dan membiarkan kemajuan reaksi kimia. Enzim adalah pemangkin biologi yang dapat mengurangkan tenaga pengaktifan tindak balas yang berlaku dalam tisu.
Apakah perbezaan antara tenaga bebas dan tenaga pengaktifan?
Tenaga dan tenaga pengaktifan bebas adalah dua istilah yang berbeza yang mempunyai aplikasi yang berbeza juga. Perbezaan utama antara tenaga bebas dan tenaga pengaktifan ialah tenaga bebas adalah jumlah tenaga yang tersedia untuk sistem termodinamik untuk melaksanakan kerja termodinamik, sedangkan tenaga pengaktifan reaksi kimia adalah halangan tenaga yang harus diatasi untuk mendapatkan produk dari tindak balas.
Berikut adalah ringkasan perbezaan antara tenaga bebas dan tenaga pengaktifan dalam bentuk jadual.
Ringkasan -Tenaga Tenaga Percuma vs Tenaga Pengaktifan
Tenaga dan tenaga pengaktifan bebas adalah dua istilah yang berbeza yang mempunyai aplikasi yang berbeza. Perbezaan utama antara tenaga bebas dan tenaga pengaktifan ialah tenaga bebas adalah jumlah tenaga yang tersedia untuk sistem termodinamik untuk melaksanakan kerja termodinamik, sedangkan tenaga pengaktifan reaksi kimia adalah halangan tenaga yang harus diatasi untuk mendapatkan produk dari tindak balas.
Rujukan:
1. Helmenstine, Anne Marie. "Definisi Tenaga Pengaktifan dalam Kimia."Thoughtco, Aug. 27, 2020, boleh didapati di sini.
Ihsan gambar:
1. "Pengaktifan2 Dikemaskini" pada asalnya dimuat naik oleh Jerry Crimson Mann, Vectorized by tutmosis, diperbetulkan oleh fvasconcellos - en: imej: pengaktifan2.PNG (CC BY-SA 3.0) melalui Commons Wikimedia


