Perbezaan antara fluorin dan fluorida

The Perbezaan utama antara fluorin dan fluorida adalah fluorin adalah neutral manakala fluorida dicas negatif.
Unsur -unsur dalam jadual berkala kecuali gas mulia tidak stabil. Oleh itu, unsur -unsur cuba bertindak balas dengan unsur -unsur lain untuk mendapatkan konfigurasi elektron gas mulia dan mencapai kestabilan. Fluorin adalah elemen yang juga perlu mendapatkan elektron untuk mencapai konfigurasi elektron gas mulia, neon. Semua logam bertindak balas dengan fluorin, membentuk fluorida. Oleh itu, terdapat perbezaan antara fluorin dan fluorida bergantung kepada sifat fizikal dan kimia mereka kerana perubahan satu elektron.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu fluorin
3. Apa itu fluorida
4. Perbandingan sampingan - Fluorine vs fluoride dalam bentuk jadual
5. Ringkasan
Apa itu fluorin?
Fluorin adalah elemen dalam jadual berkala, yang dilambangkan oleh F. Ia adalah halogen (kumpulan ke -17) dalam tempoh ke -2 jadual berkala. Bilangan fluorin atom adalah 9; Oleh itu, ia mempunyai sembilan proton dan sembilan elektron. Konfigurasi elektronnya ditulis sebagai 1s2 2s2 2p5. Oleh kerana sub sublevel harus mempunyai 6 elektron untuk mendapatkan neon, konfigurasi elektron gas mulia, fluorin mempunyai keupayaan untuk menarik elektron. Menurut skala Pauling, fluorin mempunyai elektronegativiti tertinggi dalam jadual berkala, iaitu kira -kira 4.
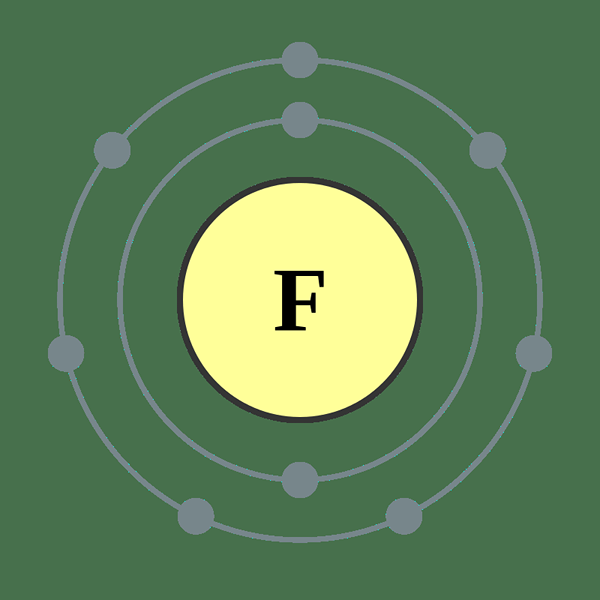
Rajah 01: Atom fluorin
Jisim atom fluorin adalah 18.9984 AMU. Pada suhu bilik, fluorin wujud sebagai molekul diatomik (F2). F2 adalah gas warna kuning -hijau pucat dan ia mempunyai titik lebur -219 ° C dan titik mendidih -188 ° C. Antara isotop fluorin, F-17 bukanlah isotop yang stabil dan ia mempunyai separuh hayat 1.8 jam. Tetapi F-19 adalah isotop yang stabil. Kelimpahan F-19 di Bumi adalah 100%. Fluorin boleh mengoksida oksigen dan keadaan pengoksidaannya ialah -1.
Gas fluorin lebih padat daripada udara dan ia juga boleh dicairkan dan dikuatkan. Ia sangat reaktif, dan ini disebabkan oleh elektronegativiti yang tinggi dan ikatan fluorin yang lemah. Selain itu, reaksi spesies kimia ini dengan kebanyakan molekul lain pantas. Kerana kereaktifan, ia tidak dijumpai sebagai elemen percuma.
Apa itu fluorida?
Fluorida adalah anion yang terbentuk apabila fluorin abstrak elektron dari elemen elektropositif yang lain. Kita boleh mewakilinya dengan simbol f-. Ia adalah ion monovalen dengan caj -1. Oleh itu, ia mempunyai 10 elektron dan sembilan proton. Selain itu, konfigurasi elektron fluorida adalah 1s2 2s2 2p6.

Rajah 02: Fluorida yang mengandungi ubat gigi
Fluorida wujud dalam sebatian ionik seperti natrium fluorida, fluorida kalsium (fluorit) dan HF. Ia juga wujud secara semula jadi dalam sumber air. Adalah diketahui bahawa ion ini membantu mencegah kerosakan gigi; Oleh itu, ia ditambah kepada ubat gigi.
Apakah perbezaan antara fluorin dan fluorida?
Fluorin adalah elemen kimia manakala fluorida adalah anion yang terbentuk. Perbezaan utama antara fluorin dan fluorida ialah fluorin adalah neutral manakala fluorida dicas negatif. Fluorin adalah elemen dalam jadual berkala yang dilambangkan oleh f manakala fluorida adalah anion yang mempunyai simbol f-. Selain itu, tidak ada elektron yang tidak berpasangan di fluorida, tetapi ada satu elektron yang tidak berpasangan dalam atom fluorin. Satu lagi perbezaan antara fluorin dan fluorida ialah unsur bebas fluorin tidak berlaku secara semulajadi, tetapi fluorida secara semula jadi berlaku di sumber air.
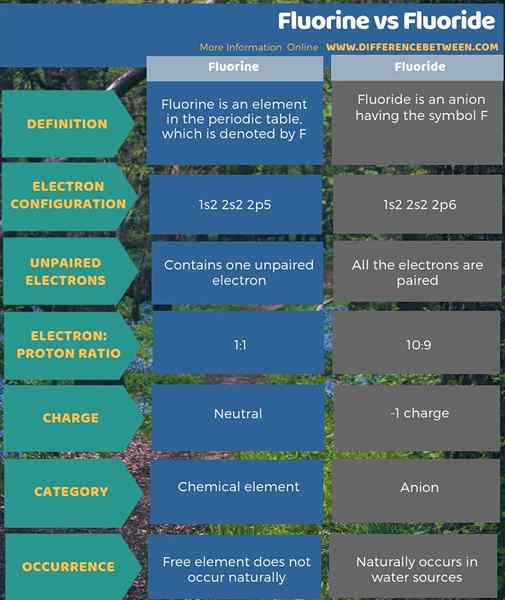
Ringkasan -Fluorine vs Fluoride
Pada asasnya, fluorin adalah elemen kimia manakala fluorida adalah anion yang membentuknya. Perbezaan utama antara fluorin dan fluorida ialah fluorin adalah neutral manakala fluorida dicas negatif.
Rujukan:
1. Miller, Bruce G. "Kesan penggunaan arang batu terhadap kesihatan manusia dan alam sekitar."Teknologi Kejuruteraan Batubara Bersih, 2017, pp. 105-144., doi: 10.1016/B978-0-12-811365-3.00003-X.
Ihsan gambar:
1. "Elektron Shell 009 Fluorine - No Label" oleh Pumbaa (karya asal oleh Greg Robson) - Fail: Electron Shell 009 Fluorine.SVG, (CC BY-SA 2.0 uk) melalui Commons Wikimedia
2. "Ubat gigi" oleh William Warby (CC oleh 2.0) melalui Flickr


