Perbezaan antara glukonat ferus dan sulfat ferus
The Perbezaan utama Antara glukonat ferus dan sulfat ferus adalah bahawa Gluconate ferrous lebih diserap ke dalam badan kita daripada sulfat ferus.
Besi adalah logam di blok D dengan simbol Fe. Ia adalah elemen keempat yang paling biasa di kerak bumi. Besi mempunyai keadaan pengoksidaan dari -2 hingga +8. Antara bentuk +2 dan +3 ini adalah yang paling biasa. +2 Bentuk pengoksidaan besi dikenali sebagai bentuk ferus dan +3 dikenali sebagai ferrik. Ion ini dalam bentuk kristal ionik, yang dibentuk dengan pelbagai anion. Besi diperlukan untuk sistem biologi untuk pelbagai tujuan. Sebagai contoh, pada manusia, ferus didapati sebagai ejen chelating dalam hemoglobin. Ia juga penting untuk sintesis klorofil dalam tumbuhan. Oleh itu, apabila terdapat kekurangan ion, sistem biologi menunjukkan pelbagai penyakit. Ferus gluconate dan sulfat ferus adalah dua sebatian ionik yang boleh diberikan sebagai suplemen ferus untuk mengatasi kekurangan besi dalam sistem hidup.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu glukonat ferus
3. Apa itu sulfat ferus
4. Perbandingan sampingan - ferus gluconate vs sulfat ferus dalam bentuk jadual
5. Ringkasan
Apa itu glukonat ferus?
Gluconate ferrous adalah garam besi asid glukonik. Kumpulan asid karboksilik asid glukonik bertindak balas dengan ferus untuk menghasilkan garam ini. Dua ion glukonat berinteraksi dengan ion ferus ketika menghasilkan garam ini. Ia mempunyai formula molekul c12H24Feo14. Jisim molar sebatian adalah 448.15. Ferrous Gluconate mempunyai struktur berikut.
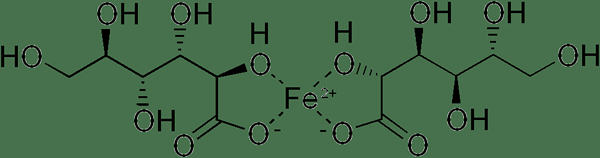
Ini adalah pepejal, yang mempunyai kuning cahaya hingga penampilan coklat/hitam dan sedikit bau karamel. Glukonat ferus larut dalam air. Ia digunakan sebagai suplemen besi ke badan. Di pasaran, ferus gluconate dipasarkan di bawah nama jenama seperti Fergon, Ferralet, dan Simron. Untuk penyakit seperti anemia hypochromic, disebabkan oleh kekurangan besi dalam badan, glukonat ferus dapat diberikan. Selanjutnya, glukonat ferus digunakan sebagai bahan tambahan makanan.
Apa itu sulfat ferus?
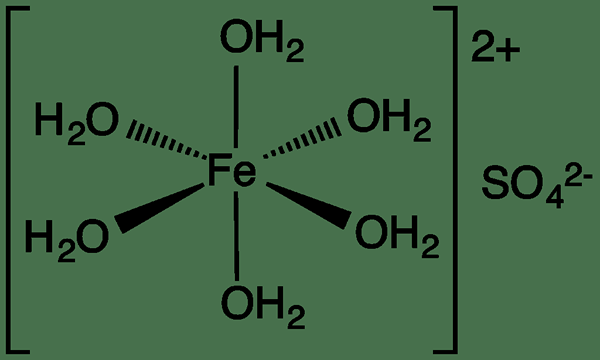
Ferrous sulfat adalah sebatian ionik dengan formula kimia FESO4. Ia mungkin wujud dalam jenis kristal yang berbeza bergantung kepada bilangan molekul air yang dilampirkan. Ia mempunyai anhydrous, monohydrate, tetrahydrate, pentahydrate, hexahydrate dan heptahydrate bentuk. Antaranya, bentuk heptahydrate warna biru-hijau adalah yang paling biasa. Bentuk monohidrat, pentahydrate dan hexahydrate agak jarang. Sebagai tambahan kepada kristal warna biru-hijau, bentuk sulfat ferus lain kebanyakannya kristal berwarna putih.

Apabila dipanaskan, kristal terhidrat kehilangan air dan menjadi pepejal anhydrous. Setelah pemanasan lebih lanjut, ia diuraikan ke dalam sulfur dioksida, sulfur trioksida dan besi (III) oksida (warna merah coklat). Mereka adalah kristal yang tidak berbau. Ferrous sulfat mudah larut dalam air dan ion ferus membentuk kompleks hexa aqua, [fe (h (h (h (h2O)6]2+. Ferrous sulfat digunakan untuk merawat keadaan kekurangan besi seperti anemia kekurangan zat besi. Ia juga ditambah kepada tumbuh -tumbuhan, juga. Dalam keadaan seperti klorosis besi, di mana daun tumbuhan menjadi kuning, warna pucat diberikan. Selain itu, ia digunakan sebagai pendahulu untuk mensintesis sebatian lain. Oleh kerana ia adalah ejen pengurangan, ia digunakan untuk reaksi redoks, juga.
Apakah perbezaan antara glukonat ferus dan sulfat ferus?
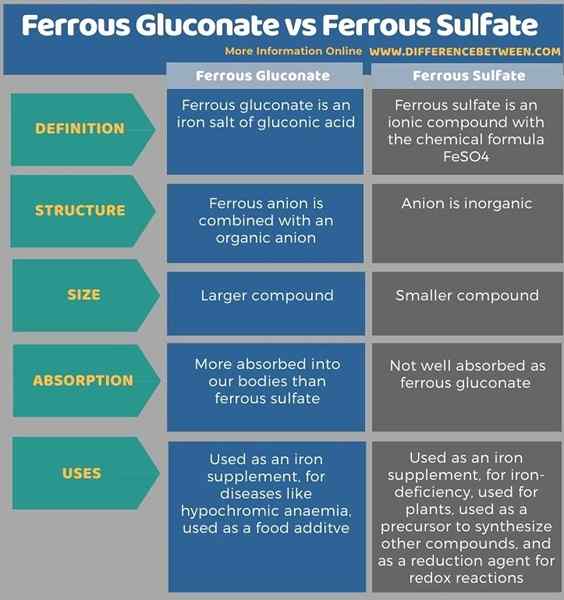
Dalam glukonat ferus, anion ferus digabungkan dengan anion organik. Dalam sulfat ferus, anion adalah bukan organik. Ferrous gluconate adalah sebatian besar berbanding dengan sulfat ferus. Sulfat feros adalah banyaknya berbanding dengan glukonat ferus. Apabila diberikan sebagai suplemen, glukonat ferus lebih diserap ke dalam badan kita daripada sulfat ferus.
Ringkasan -ferus gluconate vs sulfat ferus
Gluconate ferrous adalah garam besi asid glukonik dan sulfat ferus adalah sebatian ionik dengan formula kimia FESO4. Ini adalah suplemen besi yang digunakan untuk merawat atau mencegah kekurangan zat besi. Perbezaan utama antara glukonat ferus dan sulfat ferus adalah bahawa glukonat ferus lebih diserap ke dalam badan kita daripada sulfat ferus.
Ihsan gambar:
1. "Ferrous Gluconate" oleh Edgar181 - Kerja Sendiri (Domain Awam) melalui Commons Wikimedia
2. "Fe (H2O) 6SO4" oleh Smokefoot - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia


