Perbezaan antara endergonik dan exergonik
The Perbezaan utama antara endergonic dan exergonic adalah bahawa Reaksi endergonik tidak bersemangat dan tidak menguntungkan, sedangkan tindak balas exergonik adalah spontan dan menggalakkan.
Tenaga adalah keupayaan untuk melakukan kerja. Dalam sistem, tenaga boleh melakukan kerja dan tenaga boleh ditukar kepada bentuk lain seperti haba, bunyi, cahaya dll. Apabila tenaga sistem berubah akibat perbezaan suhu antara sistem dan sekitarnya, kami mengatakan bahawa tenaga telah dipindahkan sebagai haba. Tindak balas kimia boleh dianggap sebagai sistem. Reaksi kimia adalah proses di mana satu atau lebih sebatian ditukar menjadi satu set sebatian baru melalui satu siri perubahan.
Apabila reaksi diteruskan, boleh ada pemindahan tenaga dari sekitar ke sistem atau sebaliknya. Beberapa tindak balas ini spontan, dan ada yang tidak. Semua tindak balas yang berlaku di alam sekitar tidak spontan, tetapi kita melihat reaksi bukan spontan ini berlaku secara semula jadi. Itu kerana tindak balas bukan spontan ditambah dengan tindak balas spontan dan mereka didorong oleh tenaga tindak balas spontan.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu Endergonic
3. Apa itu exergonic
4. Perbandingan sampingan - Endergonic vs exergonic dalam bentuk jadual
5. Ringkasan
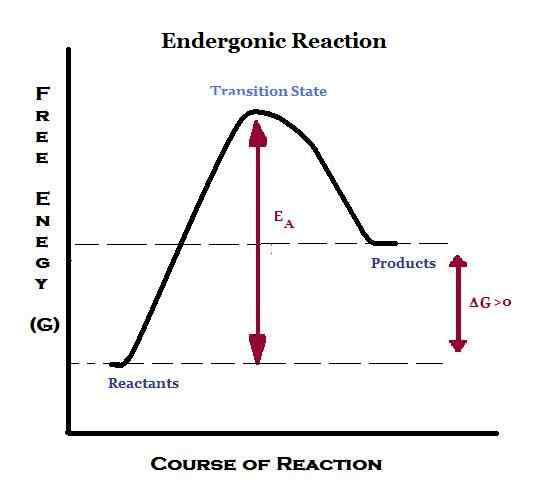
Apa itu Endergonic?
Perkataan "ender" berasal dari perkataan "endo" yang bermaksud "dalam". Oleh itu, endergonik bermaksud menyerap tenaga dalam bentuk kerja. Oleh itu, dalam reaksi endergonic, sekitarnya membekalkan tenaga ke dalam sistem. Selain itu, produk akan mempunyai tenaga yang lebih tinggi daripada reaktan. Reaksi endergonik dianggap tidak nonspontan atau tidak menguntungkan. Sekiranya pemindahan tenaga ini berlaku pada tekanan dan suhu yang berterusan, tenaga bebas gibbs standard akan positif. Oleh itu, pemalar keseimbangan untuk tindak balas endergonik adalah kurang daripada satu.

Fotosintesis adalah tindak balas endergonik yang mengambil tempat di persekitaran semula jadi. Untuk fotosintesis, tenaga dibekalkan oleh cahaya matahari. Di dalam tubuh manusia, ketika reaksi endergonic berlaku, tenaga dibekalkan oleh ATP. Oleh itu, tindak balas endergonik ditambah dengan tindak balas hidrolisis ATP.
Apa itu exergonic?
Exergonic bermaksud melepaskan tenaga dalam bentuk kerja. Dalam tindak balas ini, tenaga dilepaskan dari sistem ke luar. Reaksi exergonik adalah baik dan spontan.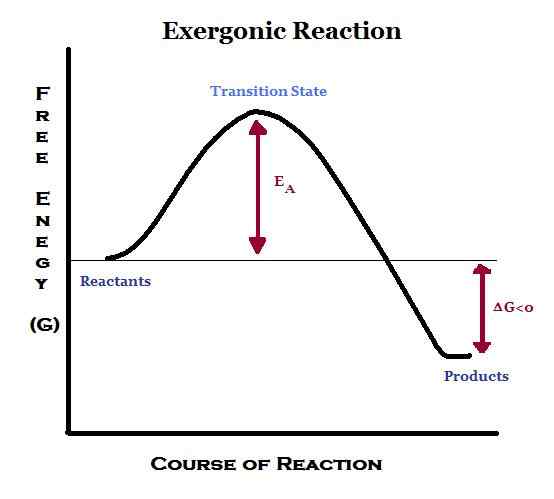
Oleh kerana tenaga dikeluarkan semasa tindak balas, produk mengandungi kurang tenaga daripada reaktan. Oleh itu, perubahan entalpi (ΔH) menjadi negatif. Selain itu, jika pemindahan dijalankan pada tekanan dan suhu malar, tenaga bebas Gibbs standard akan menjadi nilai negatif.
Apakah perbezaan antara endergonic dan exergonic?
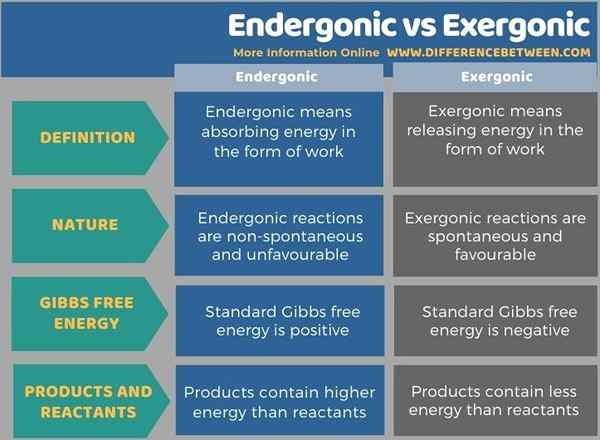
Endergonik bermaksud menyerap tenaga dalam bentuk kerja sedangkan exergonik bermaksud melepaskan tenaga dalam bentuk kerja. Perbezaan utama antara endergonic dan exergonic adalah bahawa reaksi endergonik tidak bersemangat dan tidak menguntungkan, sedangkan tindak balas exergonik adalah spontan dan menguntungkan. Tenaga bebas Gibbs standard akan positif dalam tindak balas endergonik, berbeza dengan reaksi exergonik. Dalam tindak balas exergonik, produk mengandungi kurang tenaga daripada reaktan tetapi, dalam tindak balas endergonik, produk mengandungi tenaga yang lebih tinggi daripada reaktan.
Ringkasan -Endergonic vs exergonic
Endergonik bermaksud menyerap tenaga dalam bentuk kerja sedangkan exergonik bermaksud melepaskan tenaga dalam bentuk kerja. Perbezaan utama antara endergonic dan exergonic adalah bahawa reaksi endergonik tidak bersemangat dan tidak menguntungkan, sedangkan tindak balas exergonik adalah spontan dan menguntungkan.
Ihsan gambar:
1. "Endergonic" oleh J3Hoang - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia
2. "Exergonic" oleh J3Hoang - Kerja Sendiri (CC BY -SA 3.0) melalui Commons Wikimedia


