Perbezaan antara keseimbangan dan keadaan mantap
The Perbezaan utama antara keseimbangan dan keadaan mantap ialah Dalam keseimbangan, kepekatan semua komponen dipertahankan sedangkan, dalam keadaan mantap, hanya beberapa komponen yang tetap tetap.
Apabila satu atau lebih reaktan ditukar kepada produk, mereka mungkin melalui perubahan pengubahsuaian dan tenaga yang berbeza. Ikatan kimia dalam reaktan dipecahkan, dan ikatan baru dibentuk untuk menghasilkan produk yang sama sekali berbeza dengan reaktan. Inilah yang kita panggil reaksi kimia. Keseimbangan dan keadaan mantap adalah konsep kimia yang penting mengenai tindak balas kimia yang berbeza.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah keseimbangan
3. Apa itu keadaan mantap
4. Perbandingan sampingan - Keseimbangan vs keadaan mantap dalam bentuk jadual
5. Ringkasan
Apakah keseimbangan?
Beberapa tindak balas boleh diterbalikkan, sementara beberapa tindak balas tidak dapat dipulihkan. Dalam tindak balas, reaktan ditukar kepada produk. Dalam beberapa tindak balas, reaktan menghasilkan lagi dari produk. Kami namakan tindak balas jenis ini sebagai boleh diterbalikkan. Dalam reaksi yang tidak dapat dipulihkan, apabila reaktan ditukar kepada produk, mereka tidak akan menjana semula dari produk.
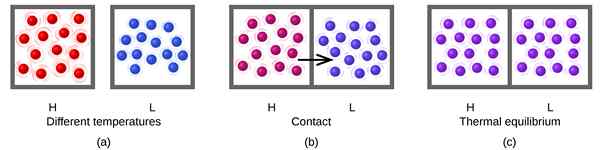
Dalam tindak balas yang boleh diterbalikkan, apabila reaktan berubah menjadi produk, kami menyebutnya reaksi ke hadapan. Apabila produk diubah menjadi reaktan, kami menyebutnya reaksi mundur. Apabila kadar tindak balas ke hadapan dan mundur adalah sama, maka tindak balas adalah pada keseimbangan. Oleh itu, jumlah reaktan dan produk tidak berubah dalam tempoh masa.

Rajah 01: Keseimbangan terma
Reaksi yang boleh diterbalikkan selalu cenderung untuk datang ke keseimbangan dan mengekalkan keseimbangan itu. Apabila sistem berada dalam keseimbangan, jumlah produk dan reaktan tidak semestinya sama. Terdapat jumlah reaktan yang lebih tinggi daripada produk atau sebaliknya. Satu -satunya keperluan dalam persamaan keseimbangan adalah mengekalkan jumlah yang berterusan dari kedua -dua masa. Untuk tindak balas dalam keseimbangan, kita dapat menentukan pemalar keseimbangan, yang sama dengan nisbah antara kepekatan produk dan kepekatan reaksi.
Apa itu keadaan mantap?
Pertimbangkan tindak balas di mana reaktan A pergi ke produk C melalui b antarabangsa. Dalam tindak balas seperti ini, B dibentuk oleh A, dan kemudian ia mengalami kekurangan untuk membentuk c. Sebelum reaksi bermula, hanya ada A, dan B perlahan -lahan mula membina. Walau bagaimanapun, dengan masa, jumlah a dikurangkan, dan c meningkat, tetapi jumlah b tetap kira -kira sama dari masa ke masa. Di negeri ini, sebaik sahaja bentuk B, ia akan berkurangan untuk memberi C pada kadar pesat mengekalkan kepekatan keadaan mantap. Oleh itu, kadar sintesis b = kadar penggunaan b.
A ⟶ b ⟶ c
Asumsi keadaan mantap: D (b)/dt = 0.
Apakah perbezaan antara keseimbangan dan keadaan mantap?
Keseimbangan dan keadaan mantap adalah konsep kimia yang penting. Perbezaan utama antara keseimbangan dan keadaan mantap adalah bahawa dalam keseimbangan, kepekatan semua komponen dipertahankan sementara, dalam keadaan mantap, hanya beberapa komponen yang tetap tetap. Dalam keseimbangan, kepekatan komponen adalah malar kerana kadar tindak balas adalah sama dalam reaksi ke hadapan dan mundur. Dalam keadaan mantap, hanya beberapa komponen yang tetap kerana kadar sintesis dan kadar penggunaannya sama. Untuk ini, tindak balas tidak semestinya berada dalam keseimbangan.
Ringkasan -Keseimbangan vs keadaan mantap
Keseimbangan dan keadaan mantap adalah konsep kimia yang penting. Perbezaan utama antara keseimbangan dan keadaan mantap adalah bahawa dalam keseimbangan, kepekatan semua komponen dipertahankan sementara, dalam keadaan mantap, hanya beberapa komponen yang tetap tetap.
Rujukan:
1.Helmenstine, Anne Marie. "Keseimbangan kimia dalam tindak balas kimia."Thoughtco, Feb. 3, 2019, boleh didapati di sini.
Ihsan gambar:
1. "CNX Chem 05 01 HeatTrans1" oleh OpenStax - (CC oleh 4.0) melalui Commons Wikimedia


