Perbezaan antara sel elektrokimia dan sel galvanik
The Perbezaan utama antara sel elektrokimia dan sel galvanik adalah Sebilangan besar sel elektrokimia cenderung menukar tenaga elektrik menjadi tenaga kimia, sedangkan sel -sel galvanik cenderung menukar tenaga kimia menjadi tenaga elektrik.
Reaksi pengoksidaan dan pengurangan memainkan peranan penting dalam elektrokimia. Dalam tindak balas pengurangan pengoksidaan, elektron dipindahkan dari satu reaktan ke yang lain. Bahan yang menerima elektron adalah ejen pengurangan, sedangkan bahan yang memberikan elektron adalah ejen pengoksidaan. Ejen pengurangan bertanggungjawab untuk mengurangkan reaktan lain semasa menjalani pengoksidaan itu sendiri; Untuk ejen pengoksidaan, ini sebaliknya. Reaksi ini berlaku dalam dua reaksi separuh untuk menunjukkan pengoksidaan dan pengurangan yang berasingan; Oleh itu, ia menunjukkan bilangan elektron yang bergerak masuk atau keluar.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apakah sel elektrokimia
3. Apa itu sel galvanik
4. Perbandingan sampingan - Sel elektrokimia vs sel galvanik dalam bentuk jadual
5. Ringkasan
Apakah sel elektrokimia?
Sel elektrokimia adalah gabungan ejen pengurangan dan pengoksidaan, yang secara fizikal dipisahkan antara satu sama lain. Biasanya, kita melakukan pemisahan ini dengan jambatan garam. Walaupun mereka dipisahkan secara fizikal, kedua-dua sel separuh berada dalam hubungan kimia antara satu sama lain. Sel elektrolitik dan galvanik adalah dua jenis sel elektrokimia.
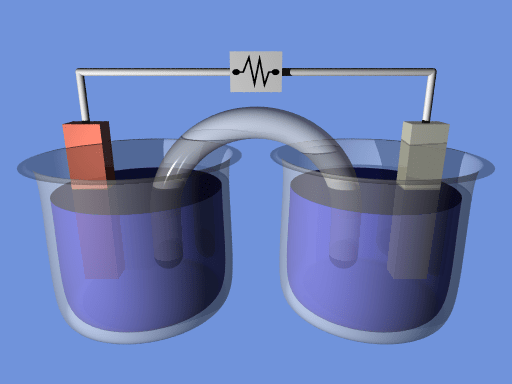
Reaksi pengurangan pengoksidaan berlaku di kedua-dua sel elektrolisis dan galvanik. Oleh itu, dalam sel elektrokimia, terdapat dua elektrod sebagai anod dan katod. Kedua -dua elektrod bersambung secara luaran dengan voltmeter tahan tinggi; Oleh itu, semasa tidak ada pemancar antara elektrod. Oleh itu, voltmeter ini membantu mengekalkan voltan tertentu antara elektrod di mana tindak balas pengoksidaan berlaku.

Rajah 01: Sel elektrokimia
Reaksi pengoksidaan berlaku pada anod, sementara tindak balas pengurangan berlaku pada katod. Kita perlu membenamkannya dalam penyelesaian elektrolit yang berasingan. Biasanya, penyelesaian ini adalah penyelesaian ionik yang berkaitan dengan jenis elektrod. Contohnya, kita membenamkan elektrod tembaga dalam larutan sulfat tembaga dan elektrod perak dalam larutan klorida perak. Penyelesaian ini berbeza; Oleh itu, mereka mesti dipisahkan. Cara yang paling biasa untuk memisahkannya adalah jambatan garam. Di dalam sel elektrokimia, tenaga berpotensi sel ditukar kepada arus elektrik, yang boleh kita gunakan untuk menyalakan mentol atau melakukan kerja elektrik lain.
Apa itu sel galvanik?
Sel galvanik atau voltan menyimpan tenaga elektrik. Bateri dibuat dari satu siri sel galvanik untuk menghasilkan voltan yang lebih tinggi. Reaksi di kedua -dua elektrod dalam sel galvanik cenderung untuk meneruskan secara spontan. Apabila reaksi berlaku, terdapat aliran elektron dari anod ke katod melalui konduktor luaran.
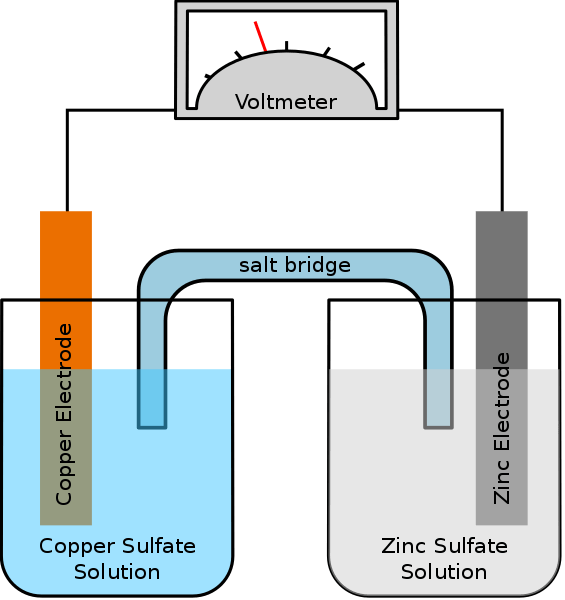
Rajah 02: Sel galvanik
Sebagai contoh, jika kedua -dua elektrod adalah perak dan tembaga dalam sel galvanik, elektrod perak adalah positif berkenaan dengan elektrod tembaga. Elektrod tembaga adalah anod, dan ia mengalami reaksi pengoksidaan dan melepaskan elektron. Elektron ini pergi ke katod perak melalui litar luaran. Oleh itu, katod perak mengalami reaksi pengurangan. Perbezaan yang berpotensi dihasilkan antara kedua -dua elektrod, yang membolehkan aliran elektron. Berikut adalah tindak balas sel spontan sel galvanik di atas.
2 AG+ (aq) + cu (s) ⇌ 2ag (s) + cu2+ (aq)
Apakah perbezaan antara sel elektrokimia dan sel galvanik?
Terdapat dua jenis sel elektrokimia sebagai sel elektrolitik dan sel galvanik. Perbezaan utama antara sel elektrokimia dan sel galvanik adalah bahawa kebanyakan sel elektrokimia cenderung menukar tenaga elektrik menjadi tenaga kimia, sedangkan sel -sel galvanik cenderung menukar tenaga kimia menjadi tenaga elektrik. Tambahan pula, dalam kebanyakan sel elektrokimia seperti sel -sel elektrolitik, anod adalah terminal positif manakala katod adalah terminal negatif; Walau bagaimanapun, dalam sel galvanik, anod adalah terminal negatif dan katod adalah terminal positif.
Selain itu, perbezaan selanjutnya antara sel elektrokimia dan sel galvanik adalah bahawa dalam sel elektrokimia, seperti sel elektrolitik, tindak balas kimia bukan spontan berlaku, tetapi dalam sel galvanik, tindak balas kimia spontan berlaku.
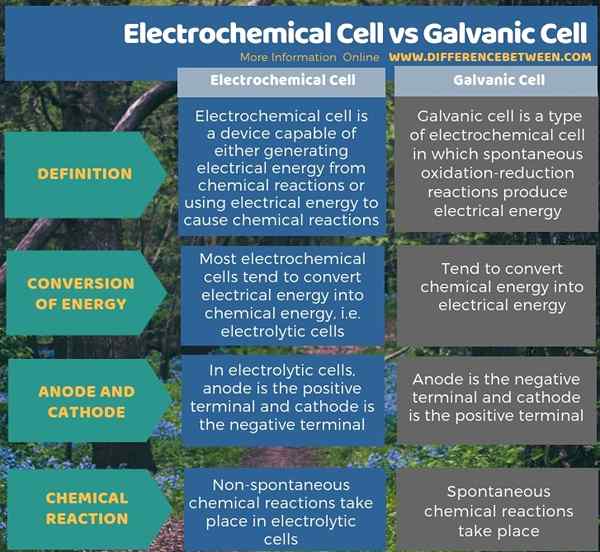
Ringkasan -Electrochemical vs dan sel galvanik
Terdapat dua jenis sel elektrokimia sebagai sel elektrolitik dan sel galvanik. Perbezaan utama antara sel elektrokimia dan sel galvanik adalah bahawa kebanyakan sel elektrokimia cenderung menukar tenaga elektrik menjadi tenaga kimia, sedangkan sel -sel galvanik cenderung menukar tenaga kimia menjadi tenaga elektrik.
Rujukan:
1."Sel Elektrokimia." Sel Elektrokimia - Gambaran Keseluruhan | Topik Sciencedirect, Terdapat di sini.
Ihsan gambar:
1. "Electrochembel" oleh Alksub di Wikipedia Inggeris (CC BY-SA 3.0) melalui Commons Wikimedia
2. "Galvanic Cell" oleh Gringer - Fail: Galvanische Zelle.PNG, oleh Tinux (CC BY-SA 3.0) melalui Commons Wikimedia


