Perbezaan antara penceraian dan solvation
The Perbezaan utama antara penceraian dan solvation adalah dissociation adalah pecahan bahan ke dalam atom atau ion yang mana bahan dibuat sedangkan solvation adalah pembubaran bahan dalam pelarut kerana daya tarikan antara molekul pelarut dan komponen bahan tersebut.
Penyisihan dan solvation sering dijumpai dalam kimia analisis dan dalam kimia tak organik, mengenai pecahan bahan kimia apabila interaksi yang berlainan antara atom dan ion dalam bahan.
Kandungan
1. Gambaran Keseluruhan dan Perbezaan Utama
2. Apa itu pemisahan
3. Apa itu Solvation
4. Perbandingan sampingan - pemisahan vs solvation dalam bentuk jadual
5. Ringkasan
Apa itu pemisahan?
Istilah pemisahan merujuk kepada kerosakan atau perpecahan sebatian menjadi zarah yang lebih kecil. Proses pemisahan membentuk produk yang sama ada secara elektrik atau netral. Maksudnya; Produk pemisahan boleh sama ada ionik atau bukan ionik. Walau bagaimanapun, ini tidak melibatkan keuntungan atau kehilangan elektron oleh atom.
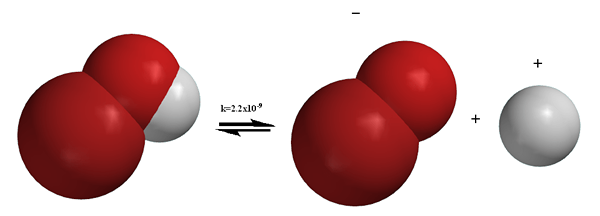
Rajah 01: Penyisihan molekul Broh
Berbeza dengan proses pengionan, pemisahan melibatkan pemisahan ion yang sudah ada di sebatian. Kadang-kadang, pemisahan juga boleh menghasilkan zarah neutral-contohnya, pecahan n2O4 menghasilkan pengeluaran dua molekul NO2. Proses pemisahan boleh diterbalikkan kebanyakan masa. Maksudnya, ion yang dipisahkan dapat diatur semula untuk menghasilkan sebatian sebelumnya. Sebagai contoh, seperti yang disebutkan di atas, pembubaran NaCl adalah proses pemisahan, dan ia menghasilkan dua zarah yang dikenakan. Tetapi, NaCl pepejal dapat diperoleh lagi dengan syarat -syarat yang tepat, yang membuktikan bahawa pemisahan boleh diterbalikkan. Tidak seperti pengionan, pemisahan berlaku dalam sebatian ionik.
Apa itu Solvation?
Solvation adalah pembubaran bahan dalam pelarut tertentu. Solvation berlaku kerana daya tarikan antara molekul pelarut dan molekul larut. Biasanya, daya tarikan yang terlibat dalam proses ini adalah ikatan ion-dipole dan tarikan ikatan hidrogen. Daya tarikan ini menyebabkan pembubaran larut dalam pelarut.

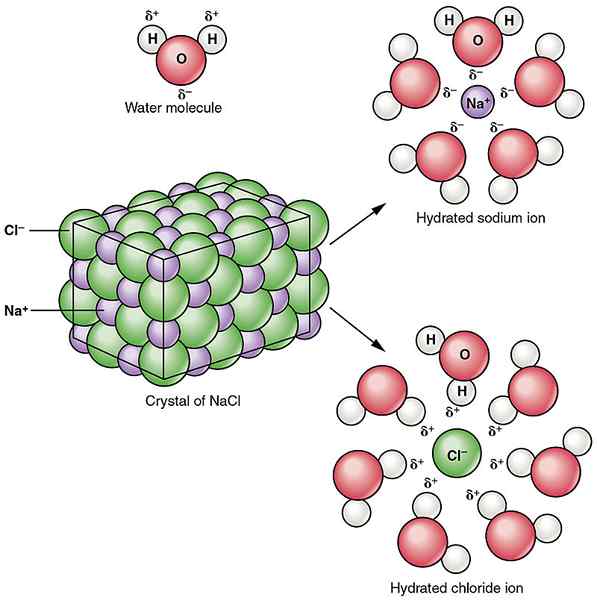
Rajah 02: Solvation of Natrium Chloride Ionic Compound in Water
Interaksi ion-dipole boleh didapati antara sebatian ionik dan pelarut kutub. E.g. Air adalah pelarut kutub. Apabila natrium klorida ditambah ke dalam air, molekul air kutub menarik ion natrium dan ion klorida secara berasingan, yang menyebabkan ion natrium dan klorida pecah. Ini mengakibatkan pecahan kompaun ionik natrium klorida.
Apakah perbezaan antara penceraian dan solvation?
Penyisihan dan solvation adalah istilah yang menggambarkan bagaimana bahan yang berbeza memecah kepingan kecil atau atom/ion bergantung pada interaksi. Perbezaan utama antara pemisahan dan solvation adalah bahawa pemisahan adalah pecahan bahan ke dalam atom atau ion yang mana bahan itu diperbuat daripada solvation adalah pembubaran bahan dalam pelarut disebabkan daya tarikan antara molekul pelarut dan komponen bahan tersebut.
Tabulasi di bawah menunjukkan lebih banyak perbezaan antara pemisahan dan solvation.
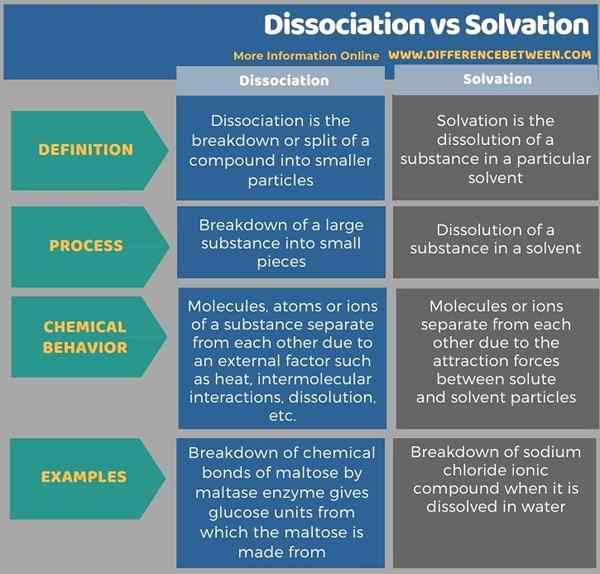
Ringkasan -Penyisihan vs solvation
Perbezaan utama antara pemisahan dan solvation adalah bahawa pemisahan adalah pecahan bahan ke dalam atom atau ion yang mana bahan itu diperbuat daripada solvation adalah pembubaran bahan dalam pelarut disebabkan daya tarikan antara molekul pelarut dan komponen bahan tersebut.
Rujukan:
1. "Penyelesaian, solvation, dan penceraian."Kimia Libreetexts, Libretexts, 5 Jun 2019, boleh didapati di sini.
2. "Solvation dan penceraian."Socratic.org, tersedia di sini.
Ihsan gambar:
1. "Pemisahan Asid Broh" oleh Achow801 - Kerja Sendiri (CC BY -SA 4.0) melalui Commons Wikimedia
2. "214 Pemisahan natrium klorida di air -01" oleh Openstax College - Anatomi & Fisiologi, Laman Web Connexions, 19 Jun 2013 (CC oleh 3.0) melalui Commons Wikimedia


