Perbezaan Antara Dipole-Dipole dan London Penyebaran
Perbezaan utama - Dipole-dipole vs London Forces Dispersion
Dipole-dipole dan daya penyebaran London adalah dua daya tarikan yang terdapat di antara molekul atau atom; mereka secara langsung mempengaruhi titik mendidih atom /molekul. The Perbezaan utama Antara dipole-dipole dan daya penyebaran London adalah kekuatan mereka dan di mana mereka dapat dijumpai. The Kekuatan daya penyebaran London agak lemah daripada interaksi dipole-dipole; namun kedua -dua tarikan ini lebih lemah daripada ikatan ionik atau kovalen. Daya penyebaran London boleh didapati di mana-mana molekul atau kadang-kadang dalam atom, tetapi interaksi dipole-dipole hanya terdapat dalam molekul kutub.
Apakah daya dipole-dipole?
Interaksi dipole-dipole berlaku apabila dua molekul polarisasi bertentangan berinteraksi melalui ruang angkasa. Daya ini wujud dalam semua molekul yang kutub. Molekul kutub dibentuk apabila dua atom mempunyai perbezaan elektronegativiti apabila mereka membentuk ikatan kovalen. Dalam kes ini, atom tidak dapat berkongsi elektron sama rata antara dua atom kerana perbezaan elektronegativiti. Lebih banyak atom elektronegatif menarik awan elektron lebih daripada atom elektronegatif yang kurang; Jadi molekul yang dihasilkan mempunyai sedikit akhir positif dan sedikit akhir negatif. Dipoles positif dan negatif dalam molekul lain dapat menarik satu sama lain, dan tarikan ini dipanggil daya dipole-dipole.

Apa itu London Daya penyebaran?
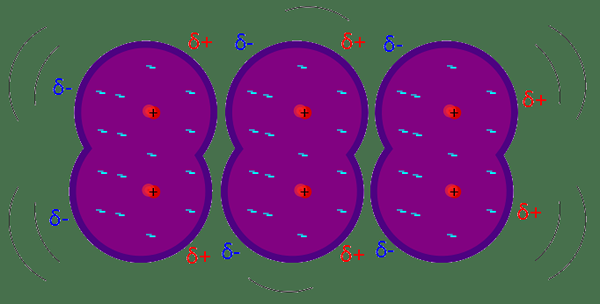
Daya penyebaran London dianggap sebagai daya intermolecular yang paling lemah antara molekul atau atom bersebelahan. Kekuatan penyebaran London mengakibatkan terdapat turun naik dalam pengedaran elektron dalam molekul atau atom. Sebagai contoh; jenis daya tarikan ini timbul di atom jiran kerana dipole seketika pada mana -mana atom. Ia mendorong dipole pada atom jiran dan kemudian menarik satu sama lain melalui daya tarikan yang lemah. Besarnya daya penyebaran London bergantung pada bagaimana elektron dengan mudah pada atom atau dalam molekul dapat dipolarisasi sebagai tindak balas kepada daya seketika. Mereka adalah kekuatan sementara yang boleh didapati dalam mana -mana molekul kerana mereka mempunyai elektron.

Apakah perbezaan antara pasukan penyebaran dipole-dipole dan london?
Definisi:
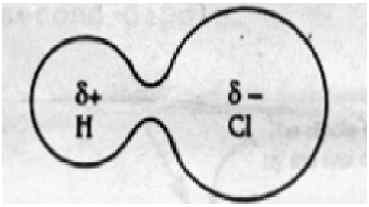
Dipole-dipole Force: Daya dipole-dipole adalah daya tarikan antara dipole positif molekul kutub dan dipole negatif dari molekul lain yang bertentangan dengan molekul.
Pasukan Penyebaran London: Daya penyebaran London adalah daya tarikan sementara antara molekul atau atom bersebelahan apabila terdapat turun naik dalam pengedaran elektron.
Alam:
Dipole-dipole Force: Interaksi dipole-dipole terdapat dalam molekul kutub seperti HCl, BRCL, dan HBR. Ini timbul apabila dua molekul berkongsi elektron secara tidak sekata untuk membentuk ikatan kovalen. Ketumpatan elektron beralih ke arah atom elektronegatif yang lebih banyak, mengakibatkan sedikit dipole negatif pada satu hujung dan sedikit dipole positif di hujung yang lain.
Pasukan Penyebaran London: Daya penyebaran London boleh didapati di mana -mana atom atau molekul; Keperluannya adalah awan elektron. Daya penyebaran London ditemui dalam molekul dan atom bukan polar juga.
Kekuatan:
Dipole-dipole Force: Daya dipole-dipole lebih kuat daripada daya penyebaran tetapi lebih lemah daripada ikatan ionik dan kovalen. Kekuatan purata daya penyebaran berbeza antara1-10 kcal/mol.
Pasukan Penyebaran London: Mereka lemah kerana daya penyebaran London adalah kekuatan sementara (0-1 kcal/mol).
Mempengaruhi faktor:
Dipole-dipole Force: Faktor yang mempengaruhi kekuatan daya dipole-dipole adalah perbezaan elektronegativiti antara atom dalam molekul, saiz molekul dan bentuk molekul. Dalam erti kata lain, apabila panjang ikatan meningkatkan interaksi dipole berkurangan.
Pasukan Penyebaran London: Besarnya daya penyebaran London bergantung kepada beberapa faktor. Ia meningkat dengan bilangan elektron dalam atom. Polarizability adalah salah satu faktor penting yang mempengaruhi kekuatan dalam daya penyebaran London; Ia adalah keupayaan untuk memesongkan awan elektron oleh atom/molekul lain. Molekul yang mempunyai elektronegativiti yang lebih rendah dan radii yang lebih besar mempunyai polarizabiliti yang lebih tinggi. Berbeza; Sukar untuk memutarbelitkan awan elektron pada atom yang lebih kecil kerana elektron sangat dekat dengan nukleus.
Contoh:
| Atom | Takat didih / oC | |
| Helium | (Dia) | -269 |
| Neon | (NE) | -246 |
| Argon | (AR) | -186 |
| Krypton | (KR) | -152 |
| Xenon | (Xe) | -107 |
| Redon | (RN) | -62 |
Rn- semakin besar atom, mudah dipolarisasi (polarizability yang lebih tinggi) dan mempunyai kekuatan menarik yang paling kuat. Helium sangat kecil dan sukar untuk memutarbelitkan dan mengakibatkan daya penyebaran London yang lebih lemah.
Ihsan gambar:
1. Dipole-dipole-Interaksi-HCL-2D oleh Benjah-Bmm27 (Kerja Sendiri) [Domain Awam], melalui Wikimedia Commons
2. Forze Di London oleh Riccardo Rovinetti (Kerja sendiri) [cc by-sa 3.0], melalui Wikimedia Commons


